题目内容
将铁屑溶于滴有KSCN溶液的过量盐酸后,再加入下列物质,溶液呈红色的是( )
| A、硫酸 | B、氯水 |
| C、氯化钾 | D、氯化铜 |
考点:铁的化学性质,二价Fe离子和三价Fe离子的检验
专题:元素及其化合物
分析:铁与盐酸反应生成二价铁离子,三价铁离子遇硫氰酸根离子显红色,所以加入的物质应具有强的氧化性能够氧化二价铁离子生成三价铁.
解答:
解:A.硫酸不具有强的氧化性,不能够将二价铁氧化成三价铁,故A错误;
B.氯水中含有氯气具有强的氧化性,加入到溶液中发生离子反应:2Fe2++Cl2=2Cl-+2Fe3+,故B正确;
C.氯化钾不具有氧化性,不能够将二价铁氧化成三价铁,故C错误;
D.二价铜离子氧化性较弱不能够将二价铁氧化成三价铁,故D错误;
故选:B.
B.氯水中含有氯气具有强的氧化性,加入到溶液中发生离子反应:2Fe2++Cl2=2Cl-+2Fe3+,故B正确;
C.氯化钾不具有氧化性,不能够将二价铁氧化成三价铁,故C错误;
D.二价铜离子氧化性较弱不能够将二价铁氧化成三价铁,故D错误;
故选:B.
点评:本题考查了二价铁与三价铁离子的转化与检验,是高考的热点,明确不同价态铁的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
将3.5g Fe、Mg合金投入到一定量的硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(HNO3被还原为NO和NO2),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、干燥后称量,质量为8.6g则收集到的气体体积V值可为( )
| A、1.12L |
| B、5.34L |
| C、7.26L |
| D、8.23L |
下列物质不会使蛋白质变性的是( )
| A、盐酸 | B、硝酸汞溶液 |
| C、硫酸铵溶液 | D、氢氧化钠溶液 |
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图下列有关说法不正确的( )
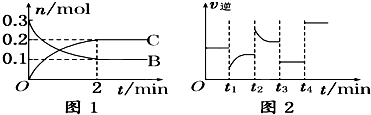

| A、反应开始2分钟内,v(B)=0.05mol/(L?min) |
| B、t1时改变的条件可能是减小了反应物的浓度 |
| C、t2时可能升高了温度 |
| D、t3时改变的条件可能是降压,此时c(B)减小 |
向50mL 18mol/L的硫酸中加入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量( )
| A、小于0.45mol |
| B、等于0.45mol |
| C、在0.45mol 和0.9mol之间 |
| D、等于0.9mol |
在给定的四种溶液中加入以下各种离子,能在原溶液中较大量共存的是( )
| A、PH=1的溶液:Fe2+、Na+、Mg2+、NO3- |
| B、滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl-、NO3- |
| C、所含溶质为NaOH的溶液中:K+、SO42-、NO3-、OH- |
| D、在碱性溶液中:K+、HCO3-、Br-、Ba2+ |
水是我们日常生活中最宝贵的资源之一.关于水的叙述正确的是( )
| A、4℃的纯水pH为7 |
| B、水的电离方程式为:H2O?2H++O2- |
| C、重水(D2O)中,质量数是质子数的两倍 |
| D、相同质量的水具有的能量:固体>液体>气体 |
