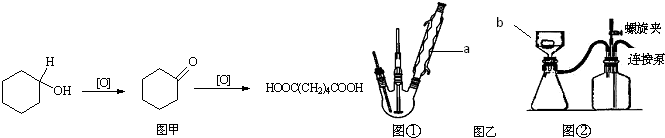
题目内容
10.利用1t含FeS2 80%的黄铁矿来制H2SO4 ,假设反应过程中由FeS2 转化为SO2时,损失硫2%,由SO2氧化成SO3 时,SO2 的利用率成只有75%,试计算1t黄铁矿可以制得95%的H2SO4 多少吨?分析 根据化学反应方程式的意义:反应前后元素质量不变,故反应前和反应后硫元素质量相等,即硫元素守恒,整个转化过程中,黄铁矿中的S元素和硫酸中的S元素守恒,得到关系式FeS2~2H2SO4,根据关系式进行计算即可.
解答 解:根据反应前后硫元素质量不变,即硫元素守恒思想可列等式进行计算,设1t黄铁矿可以制得的H2SO4 的质量是x,
则:FeS2 ~2H2SO4
120 98×2
1t×80%×(1-2%)×75% xt
所以$\frac{120}{1t×80%(1-2%)×75%}$=$\frac{98×2}{xt}$,解得 x=0.96t.可以制得95%的H2SO4 的质量是$\frac{0.96t}{95%}$=1.01t,
答:1t黄铁矿可以制得95%的H2SO4 1.01t.
点评 解答本题的关键是要掌握根据化学方程式计算的方法,注意元素守恒思想在解题中的运用.

练习册系列答案
相关题目
20.重金属离子Cu2+、Ba2+等均有毒.实验室有甲、乙两种废液,均有一定毒性.甲废液经化验呈碱性,主要有毒离子为Ba2+离子.如将甲、乙两废液按一定比例混合,毒性明显降低.乙废液中可能含有的离子是( )
| A. | Cu2+、Cl- | B. | Cu2+、SO42- | C. | Na+、SO42- | D. | Ag+、NO3- |
1.下列各项反应对应的图象正确的是( )
| A. |  25℃时,向亚硫酸溶液中通入氯气 | B. |  向 Na[Al(OH)4]溶液中通入 HCl气体 | ||
| C. |  向少量氯化铁溶液中加入铁粉 | D. |  向BaSO4饱和溶液中加入硫酸钠 |
18.在容量瓶上须要标记的是( )
| A. | 刻度线 | B. | 温度 | C. | 浓度 | D. | 容量 |
5.用NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 同温同压同体积的气体单质所含原子个数相等 | |
| B. | 常温常压下,11.2LO2所含的氧原子数为NA | |
| C. | 摩尔是沟通宏观和微观的桥梁 | |
| D. | 大规模海水淡化采用蒸馏法 |
15.下列反应的离子方程式正确的是( )
| A. | CuSO4溶液与铁粉反应:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 实验室制二氧化碳:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| C. | 二氧化碳与水反应:CO2+H2O═CO32-+2H+ | |
| D. | Na与水反应:Na+2H2O═Na++2OH-+H2↑ |
2. 转变为
转变为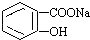 的方法是( )
的方法是( )
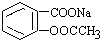 转变为
转变为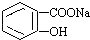 的方法是( )
的方法是( )| A. | 与足量Na0H溶液共热后,再通入CO2 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量Na0H溶液 | |
| D. | 足量稀硫酸共热后,加入足量NaHCO3 |
12.下列说法中正确的是( )
| A. | s区、d区、ds区都是金属元素 | B. | s区都是主族元素 | ||
| C. | 稀有气体元素在ds区 | D. | 所有非金属元素都在p区 |