题目内容
17.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 室温下,pH=12的NaAlO2溶液中,由水电离得OH-数目为0.01NA | |
| B. | 常温常压下,N2H4和CH3OH的混合物64g含有12NA个原子 | |
| C. | 0.1molCl2全部溶于水后转移电子的数目为0.1NA | |
| D. | 苯与液溴反应生成1mol溴苯,消耗0.5NA个Br2 |
分析 A、溶液体积不明确;
B、N2H4和CH3OH的摩尔质量均为32g/mol,且均含6个原子;
C、氯气和水的反应为可逆反应;
D、在取代反应中,当取代1molH原子时消耗1mol溴.
解答 解:A、溶液体积不明确,故溶液中水的电离出的氢氧根的个数无法计算,故A错误;
B、N2H4和CH3OH的摩尔质量均为32g/mol,故64g混合物的物质的量为2mol,且两者均含6个原子,故2mol混合物中含12mol原子即12NA个,故B正确;
C、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故A错误;
D、在取代反应中,当取代1molH原子时消耗1mol溴,故当生成1mol溴苯即有1molH原子被取代时,消耗1mol溴即NA个Br2,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
7.(NH4)2Fe(SO4)2•6H2O(硫酸亚铁铵的结晶水合物)是重要的化工原料和化学试剂,在空气中长期放置会被氧化而变质.某课题小组为了探究莫尔盐的分解产物,开展了如下实验:

(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2•6H2O分解的部分产物.装置A的气密性的检查方法是将装置A与导管相连,将该导管插入水中,后采用微热(手捂、热毛巾捂、酒精灯微热等),使装置内的气体膨胀.观察插入水中的导管是否有气泡.停止微热后,导管是否出现水柱.
已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量.
①B装置的作用是除去NH3.
②M干燥管中所放的药品是碱石灰.
(2)检验(NH4)2Fe(SO4)2•6H2O是否变质的试剂是KSCN(填化学式);检验是否完全变质的实验方法是取少量样品于试管中,加入适量蒸馏水,振荡充分溶解,再滴加酸性高锰酸钾溶液,若紫色溶液变浅,则说明样品未完全变质;若紫色溶液不变色,说明样品已完全变质.
(3)实验室常用(NH4)2Fe(SO4)2•6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O82-+2Fe2+═2Fe3++2SO42-).取w g过二硫酸铵样品溶于蒸馏水配制成250mL 溶液.准确量取20,.00mL配制的溶液于锥形瓶中,用c mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
①完成上述实验需要准确量取20.00mL过二硫酸铵溶液,所用仪器的名称是酸式滴定管或移液管.
②根据上述数据计算,样品的纯度为$\frac{c×20×1{0}^{-3}×\frac{1}{2}÷\frac{250}{20}×238}{W}$×100%(用含w、c的代数式表示).

(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2•6H2O分解的部分产物.装置A的气密性的检查方法是将装置A与导管相连,将该导管插入水中,后采用微热(手捂、热毛巾捂、酒精灯微热等),使装置内的气体膨胀.观察插入水中的导管是否有气泡.停止微热后,导管是否出现水柱.
已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量.
①B装置的作用是除去NH3.
②M干燥管中所放的药品是碱石灰.
(2)检验(NH4)2Fe(SO4)2•6H2O是否变质的试剂是KSCN(填化学式);检验是否完全变质的实验方法是取少量样品于试管中,加入适量蒸馏水,振荡充分溶解,再滴加酸性高锰酸钾溶液,若紫色溶液变浅,则说明样品未完全变质;若紫色溶液不变色,说明样品已完全变质.
(3)实验室常用(NH4)2Fe(SO4)2•6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O82-+2Fe2+═2Fe3++2SO42-).取w g过二硫酸铵样品溶于蒸馏水配制成250mL 溶液.准确量取20,.00mL配制的溶液于锥形瓶中,用c mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
②根据上述数据计算,样品的纯度为$\frac{c×20×1{0}^{-3}×\frac{1}{2}÷\frac{250}{20}×238}{W}$×100%(用含w、c的代数式表示).
8.下列有关物质性质、用途的说法都正确的是( )
| A. | 硅晶体是良好的半导体,可用于制造光导纤维 | |
| B. | 高压钠灯发出的黄光透雾能力强,可用于道路和广场照明 | |
| C. | 生石灰能与水反应,可用于除去HC1气体中少量的水蒸气 | |
| D. | 氢氧化钠具有强碱性,可用于制胃酸中和剂 |
5.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
| A. | 常温常压下,30 g乙烷气体中所含有的共价键数目为6NA | |
| B. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| C. | 常温下,1 L pH=12的氨水溶液中含有NH4+数目为0.01NA | |
| D. | 1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
12.化学与社会、科学、技术、环境、生活等有密切关系,下列说法正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 要除去衣服上的顽固污渍,均可将衣服泡在漂白液中 | |
| C. | 纤维素食用在人体内水解为葡萄糖为人体提供能量 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
2.根据如图中的实验装置,回答问题:
(1)写出图中仪器a的名称:长颈漏斗.
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为2KClO3 $\frac{\underline{\;催化剂\;}}{△}$2KCl+3O2↑,发生和收集装置为AC或AD(填字母).
(3)实验室用石灰石和稀盐酸反应智取二氧化碳,其中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置来除去,则混合气体应从F装置的②端口(填“①”或“②”)通入,F中发生的化学反应方程式为NaHCO3+HCl=2NaCl+H2O+CO2↑.
| 发生装置 | 收集装置 | 洗气装置 |
 |  |  |
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为2KClO3 $\frac{\underline{\;催化剂\;}}{△}$2KCl+3O2↑,发生和收集装置为AC或AD(填字母).
(3)实验室用石灰石和稀盐酸反应智取二氧化碳,其中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置来除去,则混合气体应从F装置的②端口(填“①”或“②”)通入,F中发生的化学反应方程式为NaHCO3+HCl=2NaCl+H2O+CO2↑.
9. 硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:
(1)写出基态30Zn原子的价电子排布式3d104s2,基态S原子核外未成对电子数为2,有5种能量不同的电子.
(2)ZnSO4中三种元素的电负性由大到小的顺序为O>S>Zn,SO42-的立体构型为正四面体形,它的等电子体是$P{O}_{4}^{3-}$(任写一种),其中SO42-中S的杂化轨道类型为sp3.
(3)Zn(NH3)4]SO4晶体中不存在的微粒间作用力有D、E.
A.离子键 B.共价键 C.配位键 D.范德华力 E.氢键
(4)根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为离子晶体;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔沸点升高..
(5)立方ZnS晶体的密度为ρg•cm-3,其晶胞结构如图.Zn2+周围等距离且最近的Zn2+、S2-依次为12、4;ZnS晶胞中的晶胞参数a=$\root{3}{\frac{4×97}{ρ×{N}_{A}}}$cm(列出计算式).
 硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:(1)写出基态30Zn原子的价电子排布式3d104s2,基态S原子核外未成对电子数为2,有5种能量不同的电子.
(2)ZnSO4中三种元素的电负性由大到小的顺序为O>S>Zn,SO42-的立体构型为正四面体形,它的等电子体是$P{O}_{4}^{3-}$(任写一种),其中SO42-中S的杂化轨道类型为sp3.
(3)Zn(NH3)4]SO4晶体中不存在的微粒间作用力有D、E.
A.离子键 B.共价键 C.配位键 D.范德华力 E.氢键
(4)根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为离子晶体;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔沸点升高..
| ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
| 熔点/℃ | 872 | 275 | 394 | 446 |
| 在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
6.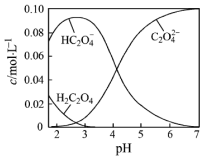 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )| A. | pH=7的溶液中:c(Na+)>2c(C2O42-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | c(HC2O4-)=c(C2O42-)的点的坐标为(4.3,0.5),则Na2C2O4的水解平衡常数为Kh=1×10-9.7 |
 .
. .
.