题目内容
10.能说明Cl比S的非金属性强的是( )①Cl2比S容易与H2化合;
②Cl2能与S2-发生置换反应;
③酸性:HClO3>H2SO3;
④与Fe反应时,Cl2比S得电子数目多;
⑤Cl2比S单质熔、沸点低
⑥酸性:HCl>H2S.
| A. | 只有④ | B. | ①②④ | C. | ①②③ | D. | ①②③④⑤ |
分析 元素非金属性强弱的判断依据:最高价氧化物对应水化物的酸性、与氢气化合的难易程度、气态氢化物的稳定性、单质的氧化性,元素非金属性强弱与其原子得电子难易程度有关,据此分析解答.
解答 解:①元素的非金属性越强,其单质的氧化性越强,其单质与氢气化合越容易,Cl2比S容易与H2化合,说明非金属性Cl>S,故正确;
②Cl2能与S2-发生置换反应,说明氯气氧化性大于S,则非金属性Cl>S,故正确;
③酸性:HClO3>H2SO3,这两种酸都不是非金属元素最高价含氧酸,所以不能据此判断非金属性强弱,故错误;
④氯气和S分别和Fe反应时前者生成氯化铁、后者生成FeS,说明氯气得电子能力大于S,所以非金属性Cl>S,故正确;
⑤Cl2比S单质熔、沸点低,与非金属性强弱无关,与分子间作用力有关,故错误;
⑥元素的非金属与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关,故错误;
故选B.
点评 本题考查非金属性强弱判断,为高频考点,侧重考查学生对元素周期律的灵活运用,非金属性强弱与得电子难易程度有关,与得电子多少及物质物理性质无关,为易错题.

练习册系列答案
相关题目
20.实验室用需配制250mL0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的Na2CO3溶液
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAFED;
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是将所有碳酸钠移入容量瓶
溶液注入容量瓶前需恢复到室温,这是因为溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏小,配制溶液的浓度偏高;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作偏低;若加蒸馏水时不慎超过了刻度偏低;若定容时俯视刻度线偏高.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面重新配制.
(1)配制250mL0.1mol/L的Na2CO3溶液
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 2.7 | 250mL | 天平、烧杯、玻璃棒、胶头滴管、药匙 |
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是将所有碳酸钠移入容量瓶
溶液注入容量瓶前需恢复到室温,这是因为溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏小,配制溶液的浓度偏高;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作偏低;若加蒸馏水时不慎超过了刻度偏低;若定容时俯视刻度线偏高.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面重新配制.
1.下列各组物质中,只用一种试剂不能鉴别的是( )
| A. | 苯酚溶液、乙醇、己烯、四氯化碳 | B. | 甲酸、乙酸、乙醛、乙醇 | ||
| C. | 淀粉溶液、乙醇、苯、四氯化碳 | D. | 苯、甲苯、己烯、溴苯 |
18.常温下,向20mL 0.5mol•L-1的CH3COOH溶液中逐滴滴加0.5mol•L-1的NaOH溶液,滴定曲线如图.相关分析正确的是( )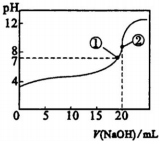

| A. | 滴加至①时,c(Na+)=c(CH3COO-),酸碱恰好完全反应 | |
| B. | 滴加至②时,c(OH-)-c(H+)=c(CH3COOH) | |
| C. | 滴定中,$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$逐渐减小 | |
| D. | 滴定中.c(CH3COOH)与c(CH3 C00-)之和保持不变 |
5.有两种气态烷烃的混合物,在标准状况下密度为1.16g•L-1,则关于此混合物组成的说法正确的是( )
| A. | 一定有乙烷 | B. | 一定有丙烷 | ||
| C. | 可能是乙烷和丙烷的混合物 | D. | 可能是甲烷和丁烷的混合物 |
15.电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )

| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
19.下列电子式书写正确的是( )
| A. | 氨气  | B. | 四氯化碳  | C. | 氮气  | D. | 过氧化氢  |
20.图1是碳的正常循环,但由于过度燃烧化石燃料,造成二氧化碳浓度不断上升.研究和解决二氧化碳捕集、存储和转化问题成为当前化学工作者的重要使命.
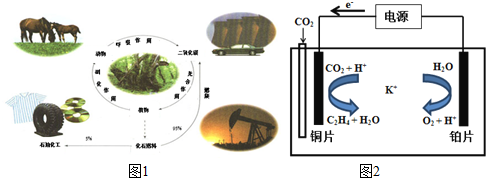
(1)有关碳循环的说法中正确的是ac
a.光合作用是光能转化成化学能
b.化石燃料是可再生的
c.循环过程有氧化还原反应
d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:2CO2(g)═2CO(g)+O2(g),该反应的△H>0,(选填:>、<、=).
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质.
2H2O(1)═2H2(g)+O2(g)△H=+571.5kJ•mol-1
3H2(g)+CO2(g)═CH3OH(l)+H2O(1)△H=-137.8kJ•mol-1
则反应:4H2O (1)+2CO2(g)═2CH3OH(l)+3O2(g)△H=+1438.9kJ•mol-1.
你认为该方法需要解决的技术问题有:ab.
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化.
c.二氧化碳及水资源的来源供应
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见下表.( t1<t2<t3)
氨基甲酸铵分解反应是吸热 反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:4×10-6.
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图).在阴极上产生乙烯的电极反应方程式为:2CO2+12H++12e-=CH2=CH2+4H2O.

(1)有关碳循环的说法中正确的是ac
a.光合作用是光能转化成化学能
b.化石燃料是可再生的
c.循环过程有氧化还原反应
d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:2CO2(g)═2CO(g)+O2(g),该反应的△H>0,(选填:>、<、=).
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质.
2H2O(1)═2H2(g)+O2(g)△H=+571.5kJ•mol-1
3H2(g)+CO2(g)═CH3OH(l)+H2O(1)△H=-137.8kJ•mol-1
则反应:4H2O (1)+2CO2(g)═2CH3OH(l)+3O2(g)△H=+1438.9kJ•mol-1.
你认为该方法需要解决的技术问题有:ab.
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化.
c.二氧化碳及水资源的来源供应
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见下表.( t1<t2<t3)
温度(℃) 气体总浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
| t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
| t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图).在阴极上产生乙烯的电极反应方程式为:2CO2+12H++12e-=CH2=CH2+4H2O.