题目内容
8.80℃时水的离子积常数KW=3.6×10-13,该温度时纯水的pH值( )| A. | 等于7 | B. | 小于7? | C. | 大于 | D. | 无法确定 |
分析 水的电离过程为吸热反应,温度升高,水的电离程度增大,溶液中的氢离子浓度增大,根据pH=-lgc(H+)可知,溶液的pH小于7,据此进行解答.
解答 解:常温下,水的离子积为1×10-14,纯水中氢离子浓度与氢氧根离子浓度相等,溶液的pH=7;
升高温度,水的电离程度增大,水中氢离子浓度增大,pH=-lgc(H+)可知,氢离子浓度越大,pH越小,所以80℃时pH<7,
故选B.
点评 本题考查了水的电离与溶液pH的判断,题目难度不大,注意掌握氢离子浓度与pH之间转化关系,明确水的电离为吸热反应,温度升高水的纯程度增大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
19. 工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
 工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )| A. | 增大压强 | B. | 降低温度 | C. | 升高温度 | D. | 分离出氨气 |
16.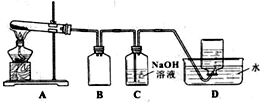 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选择的试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水.(提示:K3[Fe(CN)6]溶液和亚铁离子结合生成蓝色沉淀).
(1)请完成下表:
【实验结论】Fe的氧化产物为Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束后,试管中残留固体为黑色.
(2)装置B的作用是防倒吸.
(3)经小组讨论并验证该无色气体为O2,其验证方法是用带火星的木条深入集气瓶中,木条复燃证明无色气为氧气.
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水.
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验.
【实验评价】根据上述实验,不能确定固体产物成分的实验是b(填实验编号).
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有Ag、NO2、O2.
 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选择的试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水.(提示:K3[Fe(CN)6]溶液和亚铁离子结合生成蓝色沉淀).
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | ① | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ②,振荡 | ③ | 存在Fe2+ |
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束后,试管中残留固体为黑色.
(2)装置B的作用是防倒吸.
(3)经小组讨论并验证该无色气体为O2,其验证方法是用带火星的木条深入集气瓶中,木条复燃证明无色气为氧气.
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水.
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有Ag、NO2、O2.
3.国家电网表示促进新能发展和大范围优化配置,是电力工业科学发展的方向.下列关于能的说法中不正确的是( )
| A. | 发展核能发电,以减少火力发电带的SO2和CO2的排放问题 | |
| B. | 氢能是洁净的能,具有热值高、资丰富的优点 | |
| C. | 发展低碳经济,利用太阳能、风能实现城市照明 | |
| D. | 车用乙醇汽油具有提高燃油品质、无二氧化碳排放、燃烧充分等优点 |
18.下列试剂不能用于除去H2中混有的CO2杂质的是( )
| A. | NaOH溶液 | B. | Na2CO3溶液 | C. | Ba(OH)2溶液 | D. | H2SO4溶液 |

 .
. .
.