题目内容
6.氢化铵与氯化铵结构相似,下列叙述中不正确的是( )| A. | NH4H的电子式为 | |
| B. | 1molNH5中含有5NA个N-H键(NA表示阿伏伽德罗常数的数值) | |
| C. | NH4H中的H-半径比锂离子半径大 | |
| D. | NH4H晶体既有共价键又有离子键 |
分析 A.NH4H是离子化合物,由铵根离子与氢负离子构成;
B.依据氯化铵,可知氢化铵是由氨根离子与氢负离子构成;
C.电子层结构相同,核电荷数越大,离子半径越小;
D.氨根离子与氢负离子形成离子键,铵根离子中N与H之间形成共价键.
解答 解:A.NH4H是离子化合物,由铵根离子与氢负离子构成,电子式为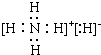 ,故A正确;
,故A正确;
B.氢化铵是由氨根离子与氢负离子构成,1molNH5中含有4NA个N-H键,故B错误;
C.H-离子与锂离子电子层结构相同,核电荷数越大,离子半径越小,所以H-离子半径比锂离子半径大,故C正确;
D.氨根离子与氢负离子形成离子键,铵根离子中N与H之间形成共价键,故D正确;
故选B.
点评 本题考查了铵盐的性质与结构,明确氢化铵的结构及性质是解题关键,注意氢化铵中所含氢元素化合价,题难度不大.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
16.下列离子方程式错误的是( )
| A. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| B. | 硫酸铝与氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 氯气与氢氧化钾溶液反应:Cl2+OH-═Cl-+ClO-+H2O | |
| D. | 小苏打溶液与稀盐酸反应:CO32-+2H+═H2O+CO2↑ |
17.下表为元素周期表中的一部分,表中列出10种元素在周期表中的位置,按要求回答下列各题:
(1)上述10种元素中,金属性最强的元素的元素符号是K,其单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑.
(2)①③⑤三种元素最高价氧化物对应水化物中碱性最强的是(填化学式)NaOH.
(3)元素①和⑦点燃时形成的化合物的化学式为Na2O2.该化合物的焰色为黄色.该化合物溶液与元素⑧的单质反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O.
(4)②③⑤三种元素形成的离子,离子半径由大到小的顺序是K+>Mg2+>Al3+.(用微粒符号表示)
(5)元素⑧的最高价氧化物的水化物的化学式为HClO4.
(6)下列能说明氯元素比硫元素非金属性强的是:②③④.(填序号)
①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸; ③S2-易被氯气氧化成S;
④氯化氢比硫化氢稳定; ⑤稀盐酸不跟铜反应,浓硫酸能跟铜反应.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①③⑤三种元素最高价氧化物对应水化物中碱性最强的是(填化学式)NaOH.
(3)元素①和⑦点燃时形成的化合物的化学式为Na2O2.该化合物的焰色为黄色.该化合物溶液与元素⑧的单质反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O.
(4)②③⑤三种元素形成的离子,离子半径由大到小的顺序是K+>Mg2+>Al3+.(用微粒符号表示)
(5)元素⑧的最高价氧化物的水化物的化学式为HClO4.
(6)下列能说明氯元素比硫元素非金属性强的是:②③④.(填序号)
①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸; ③S2-易被氯气氧化成S;
④氯化氢比硫化氢稳定; ⑤稀盐酸不跟铜反应,浓硫酸能跟铜反应.
14.如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
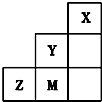

| A. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 | |
| B. | 离子半径:M->Z2->Y- | |
| C. | 稳定性:HY<HM | |
| D. | 非金属性:Y>M>Z |
11.下列实验操作中,不正确的是( )
| A. | 配制1.00mol/LNaCl溶液时,将称好的NaCl固体直接放入容量瓶中溶解 | |
| B. | 蒸馏时,冷却水从冷凝管的下口通入,上口流出 | |
| C. | 用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出 | |
| D. | 用四氯化碳萃取碘水中的碘单质 |
18.分子式为C9H10O2的含有一价苯环的所有酯类同分异构体有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
15.下列说法正确的是( )
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氨气是弱电解质,铜是强电解质 | |
| C. | 体积和氢离子浓度都相同的盐酸和醋酸溶液中和同种NaOH溶液,消耗氢氧化钠一样多 | |
| D. | 等浓度等体积的盐酸和醋酸溶液中和同种NaOH溶液,消耗氢氧化钠一样多 |
16.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
| A. | 将CO2溶于水中 | B. | Na2O2溶于水中 | C. | 将SO3溶于水中 | D. | NaHSO4溶于水中 |
