题目内容
等物质的量的 SO2 和 SO3 相比较,下列结论错误的是( )
| A、它们的分子数目之比是 1:1 |
| B、它们的氧原子数目之比为 2:3 |
| C、它们的质量之比为 1:1 |
| D、它们所含原子数目之比为 3:4 |
考点:物质分子中的原子个数计算,物质的量的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据N=nNA可知物质的量相同时,分子数之比等于物质的量之比;
B、根据N=nNA可知物质的量相同时,分子数之比等于物质的量之比,再计算氧原子数之比分析;
C、根据m=nM可知物质的量相同时,质量之比等于物质的摩尔质量之比;
D、根据N=nNA可知物质的量相同时,分子数之比等于物质的量之比,再计算原子数之比分析;
B、根据N=nNA可知物质的量相同时,分子数之比等于物质的量之比,再计算氧原子数之比分析;
C、根据m=nM可知物质的量相同时,质量之比等于物质的摩尔质量之比;
D、根据N=nNA可知物质的量相同时,分子数之比等于物质的量之比,再计算原子数之比分析;
解答:
解:A、等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,故A正确;
B、等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有2个氧原子,1个SO3分子中含有3个氧原子,则所含O原子数之比为(1×2):(1×3)=2:3,故B正确;
C、等物质的量的SO2和SO3质量之比等于物质的摩尔质量之比=64:80=4:5,故C错误;
D、等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有3个原子,1个SO3分子中含有4个原子,则原子总数之比为(1×3):(1×4)=3:4,故D正确;
故选:C.
B、等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有2个氧原子,1个SO3分子中含有3个氧原子,则所含O原子数之比为(1×2):(1×3)=2:3,故B正确;
C、等物质的量的SO2和SO3质量之比等于物质的摩尔质量之比=64:80=4:5,故C错误;
D、等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有3个原子,1个SO3分子中含有4个原子,则原子总数之比为(1×3):(1×4)=3:4,故D正确;
故选:C.
点评:本题考查有关物质的量的计算,并结合原子、分子个数的计算方法解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组中两种气体的分子数一定相同的是( )
| A、温度相同、体积相同的O2和CH4 |
| B、压强相同、体积相同的O2和H2 |
| C、质量相同、密度不同的CO和N2 |
| D、体积相同、密度不同的CO和C2H4 |
质量相同的两种气体A、B,在同温同压下,A的密度小于B,下列说法错误的是( )
| A、A的体积比B大 |
| B、A的摩尔质量比B大 |
| C、A的分子数比B多 |
| D、A的物质的量比B大 |
某温度下,0.1mol?L-1NaHCO3溶液pH=10,下列判断正确的是( )
| A、溶液中碳酸氢根电离的氢离子浓度为10-10mol?L-1 |
| B、c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| C、溶液中水电离的氢氧根离子浓度为10-4mol?L-1 |
| D、c(Na+)+c(H+)=c(HCO3-)+c(OH-) |
对1mol/L的Na2SO4溶液的叙述中正确的是( )
| A、溶液中含有1 mol Na2SO4 |
| B、1 L溶液中含有142 g Na2SO4 |
| C、1 mol Na2SO4溶于1 L水 |
| D、从1 L该溶液中取出500 mL以后,剩余溶液的浓度为0.5 mol/L |
据图判断下列说法不正确的是( )
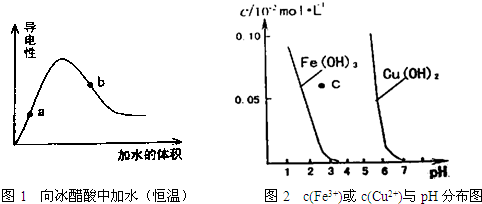

| A、图1中醋酸电离平衡常数:a点的比b点的小 |
| B、图1中醋酸溶液的pH:a点的比b点的大 |
| C、图2中c点对应的溶液为Fe(OH)3的不饱和溶液 |
| D、由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调PH约为4左右 |
重金属离子具有毒性.在珠三角某地有甲、乙两个厂排放的重金属离子的废液,甲厂废液经化验主要含有毒的Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低.则乙厂废液中可能含有的离子是( )
| A、Cu2+和SO42- |
| B、Cu2+和Cl- |
| C、K+和SO42- |
| D、Ag+和NO3- |
