题目内容
5.以乙烯为原料合成环状化合物 E(C4H4O4)的流程如下.[乙烯]$→_{①}^{HBrO}$[A]$→_{②}^{Cu/O_{2}}$[B]$→_{③}^{O_{2},催化}$[C]$→_{④}^{NaOH/H_{2}O}$[D]$→_{⑤}^{浓硫酸,加}$[E]
请回答下列问题:
(1)E 的结构简式是
 ;C 中所含官能团的名称是羧基和溴原子.
;C 中所含官能团的名称是羧基和溴原子.(2)在乙烯的同系物中,所有碳原子一定共平面且碳原子数最多的分子的结构简式是(CH3)2C=C(CH3)2,名称(系统命名)是2,3-二甲基-2-丁烯.
(3)反应①〜⑤中,属于取代反应的是④⑤(填写编号).
(4)写出反应②的化学方程式2HOCH2CH2Br+O2$→_{△}^{Cu}$2CH2BrCHO+2H2O.
(5)F是E的同分异构体,且1mol F与足量的 NaHCO3溶液反应可放出2mol CO2气体,请写出符合条件的F的所有的结构简式HOOCCH=CHCOOH、CH2=C(COOH)2.
(6)参照上述合成路线的表示,设计以乙烯为原料制备乙二醇的最简合成路线:
 .
.
分析 乙烯和HBrO发生加成反应生成A,A能发生催化氧化,说明A中含有醇羟基,则A结构简式为HOCH2CH2Br,B为CH2BrCHO,B被氧化生成C,C为CH2BrCOOH,C和NaOH的水溶液加热发生取代反应然后酸化得到D,D为HOCH2COOH,D在浓硫酸作催化剂、加热条件下发生酯化反应生成E,E是环状化合物,则E结构简式为 ,
,
(6)乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成乙二醇,据此分析解答.
解答 解:乙烯和HBrO发生加成反应生成A,A能发生催化氧化,说明A中含有醇羟基,则A结构简式为HOCH2CH2Br,B为CH2BrCHO,B被氧化生成C,C为CH2BrCOOH,C和NaOH的水溶液加热发生取代反应然后酸化得到D,D为HOCH2COOH,D在浓硫酸作催化剂、加热条件下发生酯化反应生成E,E是环状化合物,则E结构简式为 ,
,
(1)通过以上分析知,E的结构简式是 ;C为CH2BrCOOH,C中所含官能团的名称是羧基、溴原子,
;C为CH2BrCOOH,C中所含官能团的名称是羧基、溴原子,
故答案为: ;羧基和溴原子;
;羧基和溴原子;
(2)在乙烯的同系物中,所有碳原子一定共平面且碳原子数最多的分子的结构简式是(CH3)2C=C(CH3)2,名称(系统命名)是2,3-二甲基-2-丁烯,
故答案为:(CH3)2C=C(CH3)2;2,3-二甲基-2-丁烯;
(3)通过以上分析知,反应①~⑤中,属于取代反应的是④⑤,
故答案为:④⑤;
(4)A结构简式为HOCH2CH2Br,B为CH2BrCHO,A发生催化氧化反应生成B,所以反应②的化学方程式2HOCH2CH2Br+O2$→_{△}^{Cu}$2CH2BrCHO+2H2O,
故答案为:2HOCH2CH2Br+O2$→_{△}^{Cu}$2CH2BrCHO+2H2O;
(5)E的结构简式是 ,F是E的同分异构体,且1mol F与足量的NaHCO3溶液反应可放出2mol CO2气体,说明F中含有两个羧基,则符合条件的F的所有的结构简式为HOOCCH=CHCOOH、CH2=C(COOH)2,
,F是E的同分异构体,且1mol F与足量的NaHCO3溶液反应可放出2mol CO2气体,说明F中含有两个羧基,则符合条件的F的所有的结构简式为HOOCCH=CHCOOH、CH2=C(COOH)2,
故答案为:HOOCCH=CHCOOH、CH2=C(COOH)2;
(6)乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成乙二醇,所以以乙烯为原料制备乙二醇的最简合成路线: ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据反应条件及某些物质分子式进行推断,难点是同分异构体结构简式确定,题目难度不大.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 12g(锌粒) | 0.1mol/L | 153s |
| ② | 10g(锌粉) | 0.1mol/L | 125s |
| ③ | 10g(锌粉) | 0.2mol/L | 62s |
(2)写出该反应的化学方程式Zn+H2SO4=ZnSO4+H2↑,该反应中还原剂是Zn,从反应分类角度来看,该反应既属于氧化还原反应,又属于置换反应(填四大基本反应类型之一).
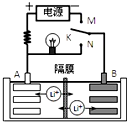 如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:LiMnO2+C6$?_{放电}^{充电}$Li1-xMnO2+LixC6(LixC6表示锂原子嵌入石墨形成的复合材料),下列有关说法正确的是( )
| A. | K与N相接时,A极为负极,该电极反应式为:LixC6-xeˉ=C6+xLi+ | |
| B. | 该电池的比能量与用单质锂作电极的锂电池的比能量相同 | |
| C. | K与M相接时,A极发生氧化反应,LiMnO2-xeˉ=Li1-xMnO2+xLi+ | |
| D. | K与N相接时,Li+由A极区迁移到B极区 |
| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | C4H6 |

| A. | 该有机物的分子式为C12H14NO4 | |
| B. | 该有机物既可与盐酸反应,又可与NaOH溶液反应 | |
| C. | 该有机物中含有2个手性碳原子 | |
| D. | 1mol该有机物最多只能与1molBr2发生取代反应 |
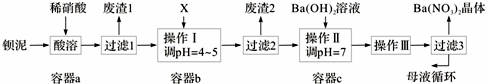
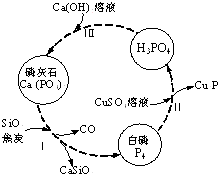 氮、磷及其化合物在科研及生产中均有着重要的应用.
氮、磷及其化合物在科研及生产中均有着重要的应用.
 ;
; ,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热.
,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热. 将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.
将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.