题目内容
 能源是人类生存和发展的重要支柱,碳元素的单质及化合物是人类生产生活的主要能源物质.
能源是人类生存和发展的重要支柱,碳元素的单质及化合物是人类生产生活的主要能源物质.(1)有机物M经过太阳光光照可转化为N,转化过程如下:

则M、N相比,较稳定的是
(2)CO可用于合成燃料甲醇.在有催化剂存在的10L恒容密闭容器中充入2mol CO和4mol H2,发生如下反应:CO(g)+2H2(g)?CH3OH(g).
测得CO的平衡转化率与温度、压强的关系如图所示:
①判断上述反应达到平衡状态的依据是
A.CH3OH的生成速率与CO的消耗速率相等
B.CH3OH、CO、H2的浓度都不再发生变化
C.混合气体的密度不变
D.混合气体的相对平均分子质量不变
②下列措施中,能使上述平衡体系中
| n(CH3OH) |
| n(CO) |
A.降低温度 B.充入He(g),使体系压强增大 C.再充入1mol CO和2mol H2
③100℃时反应在5min末达到平衡,则从反应开始至达平衡,v(H2)=
考点:用化学平衡常数进行计算,化学平衡的影响因素,化学平衡状态的判断
专题:
分析:(1)依据物质能量越高越活泼分析判断;
(2)①反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
②A.反应是放热反应,降低温度平衡正向进行;
B.充入He(g),使体系压强增大,总压增大,分压不变,平衡不变;
C.再充入1mol CO和2mol H2 ,相当于增大压强平衡正向进行;
③依据化学平衡三段式列式计算,反应速率=
,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
(2)①反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
②A.反应是放热反应,降低温度平衡正向进行;
B.充入He(g),使体系压强增大,总压增大,分压不变,平衡不变;
C.再充入1mol CO和2mol H2 ,相当于增大压强平衡正向进行;
③依据化学平衡三段式列式计算,反应速率=
| △c |
| △t |
解答:
解:(1)有机物M经过太阳光光照可转化为N的关系是吸收能量,则N能量高,比M活泼,较稳定的化合物为M;
故答案为:M;
(2)①CO(g)+2H2(g)?CH3OH(g),依据图象分析可知,随温度升高,一氧化碳转化率减小,说明平衡逆向进行,则正反应是放热反应;同温度下压强越大平衡正向进行;
A.CH3OH的生成速率与CO的消耗速率相等,证明反应正向进行,不能说明反应达到平衡状态,故A错误;
B.CH3OH、CO、H2的浓度都不再发生变化是化学平衡的标志,故B正确;
C.容器的体积不变,混合气体的质量不变,混合气体的密度始终不变,混合气体密度不变,不能说明到达平衡,故C错误;
D.混合气体的质量不变,混合气体的物质的量减小,随反应进行平均相对分子质量增大,混合气体的平均相对分子质量不变,说明反应达到平衡状态,故D正确;
故选BD;
②A.反应是放热反应,降低温度平衡正向进行,比值增大,故A正确;
B.充入He(g),使体系压强增大,总压增大,分压不变,平衡不变,故B错误;
C.再充入1mol CO和2mol H2 ,相当于增大压强平衡正向进行,比值增大,故C正确;
故答案为:AC;
③在有催化剂存在的10L恒容密闭容器中充入2mol CO和4mol H2,100℃时反应在5min末达到平衡,一氧化碳转化率为50%,反应的一氧化碳物质的量浓度为0.2×50%=0.1mol/L,发生如下反应,依据化学平衡三段式列式计算:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.2 0.4 0
变化量(mol/L) 0.1 0.2 0.1
平衡量(mol/L) 0.1 0.2 0.1
则从反应开始至达平衡,v(H2)=
=0.04mol/L?min;
平衡常数K=
=25;
故答案为:0.04,25.
故答案为:M;
(2)①CO(g)+2H2(g)?CH3OH(g),依据图象分析可知,随温度升高,一氧化碳转化率减小,说明平衡逆向进行,则正反应是放热反应;同温度下压强越大平衡正向进行;
A.CH3OH的生成速率与CO的消耗速率相等,证明反应正向进行,不能说明反应达到平衡状态,故A错误;
B.CH3OH、CO、H2的浓度都不再发生变化是化学平衡的标志,故B正确;
C.容器的体积不变,混合气体的质量不变,混合气体的密度始终不变,混合气体密度不变,不能说明到达平衡,故C错误;
D.混合气体的质量不变,混合气体的物质的量减小,随反应进行平均相对分子质量增大,混合气体的平均相对分子质量不变,说明反应达到平衡状态,故D正确;
故选BD;
②A.反应是放热反应,降低温度平衡正向进行,比值增大,故A正确;
B.充入He(g),使体系压强增大,总压增大,分压不变,平衡不变,故B错误;
C.再充入1mol CO和2mol H2 ,相当于增大压强平衡正向进行,比值增大,故C正确;
故答案为:AC;
③在有催化剂存在的10L恒容密闭容器中充入2mol CO和4mol H2,100℃时反应在5min末达到平衡,一氧化碳转化率为50%,反应的一氧化碳物质的量浓度为0.2×50%=0.1mol/L,发生如下反应,依据化学平衡三段式列式计算:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.2 0.4 0
变化量(mol/L) 0.1 0.2 0.1
平衡量(mol/L) 0.1 0.2 0.1
则从反应开始至达平衡,v(H2)=
| 0.2mol/L |
| 5min |
平衡常数K=
| 0.1 |
| 0.1×0.22 |
故答案为:0.04,25.
点评:本题考查了化学平衡、平衡图象的理解应用,化学平衡影响因素分析判断,平衡常数和反应速率概念的计算,掌握平衡移动原理和基础是关键,题目难度中等.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
Fe(OH)3胶体和FeCl3溶液共同具备的性质是( )
| A、都比较稳定,都呈红褐色 |
| B、都有丁达尔现象 |
| C、加入足量盐酸,均可发生化学反应 |
| D、分散质微粒均可透过滤纸 |
 如图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| A、X是HCl,Y是饱和食盐水 |
| B、X是CO2,Y是稀H2SO4 |
| C、X是SO2,Y是NaOH溶液 |
| D、X是NH3,Y是NaNO3溶液 |
某无素原子的核外有四个能层,最外能层有1个电子,该原子核内的质子数不能为( )
| A、24 | B、18 | C、19 | D、29 |
a g Mg、Al合金完全溶解在C1 mol?L-1、V1L HCl溶液中,产生b g H2.再向反应后的溶液中加入C2mol?L-1、V2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g.下列关系错误的是( )
A、铝为
| ||
B、C1=
| ||
| C、d=a+17b | ||
| D、与金属反应后剩余盐酸为(C1V1-b)mol |
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品.苹果酸(2羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为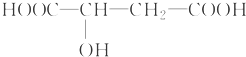 .下列相关说法不正确的是( )
.下列相关说法不正确的是( )
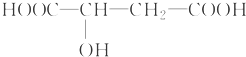 .下列相关说法不正确的是( )
.下列相关说法不正确的是( )| A、苹果酸在一定条件下能发生酯化反应 |
| B、苹果酸在一定条件下能发生催化氧化反应 |
| C、1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下) |
| D、1 mol苹果酸与Na2CO3溶液反应一定消耗2 mol Na2CO3 |
 验室用如图所示的装置制取乙酸乙酯.
验室用如图所示的装置制取乙酸乙酯.