题目内容
19.用NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 8g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 17g氨气所含电子数目为8NA |
分析 A、求出氢气的物质的量,然后根据分子个数N=nNA来分析;
B、水在标况下为液态;
C、求出钠的物质的量,然后根据按反应后变为+1价来分析;
D、求出氨气的物质的量,然后根据氨气中含10个电子来分析.
解答 解:A、4g氢气的物质的量为2mol,故分子个数N=nNA=2NA个,故A正确;
B、水在标况下为液态,故不能根据气体摩尔体积来计算其体积,故B错误;
C、2.3g钠的物质的量为0.1mol,而反应后变为+1价,故0.1mol钠反应失去0.1NA个电子,故C错误;
D、17g氨气的物质的量为1mol,而氨气中含10个电子,故1mol氨气中含10NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.镁条在空气中燃烧后,其生成的产物可能含有的物质是( )
| A. | MgCO3、MgO、Mg2N3 | B. | MgCO3、MgO、Mg(OH)2 | C. | MgO、Mg2N3、C | D. | MgCO3、C、Mg2N3 |
10.FeCl2是一种常用的还原剂.有关数据如下:
实验室可以用多种方法来制备无水FeCl2.回答下列问题:

I.按如图1装置用H2还原无水FeCl3制取.
(1)用装置A制取H2,其优点是随开随用以及通过开关弹簧夹,可以使反应随时进行或停止;D中反应的化学方程式为H2+2FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl2+2HCl.
(2)装置E的作用是吸收氯化氢气体同时防止空气中的水份进入D装置.
Ⅱ.按右图装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128℃~139℃加热3h,反应接近100%.反应如下:2FeCl3+C6H5Cl→FeCl2+C6H4Cl2+HCl
(3)上述反应中,还原剂是C6H5Cl.
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失.原因是实验使用了冷凝回流装置.
(5)冷却后,将三颈瓶内物质经过过滤,洗涤,干燥后,得到粗产品.
①洗涤所用的试剂可以是苯;
②简述回收滤液中C6H5Cl的方案蒸馏滤液,并收集132℃馏分.
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率.若要监控氯化铁转化率达到或超过80%,则烧杯中应加入含溶质为16g且滴有酚酞的NaOH溶液(忽略滞留在装置中的气体).
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
| 相对式量 | 112.5 | 147 | 162.5 | 128 |

I.按如图1装置用H2还原无水FeCl3制取.
(1)用装置A制取H2,其优点是随开随用以及通过开关弹簧夹,可以使反应随时进行或停止;D中反应的化学方程式为H2+2FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl2+2HCl.
(2)装置E的作用是吸收氯化氢气体同时防止空气中的水份进入D装置.
Ⅱ.按右图装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128℃~139℃加热3h,反应接近100%.反应如下:2FeCl3+C6H5Cl→FeCl2+C6H4Cl2+HCl
(3)上述反应中,还原剂是C6H5Cl.
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失.原因是实验使用了冷凝回流装置.
(5)冷却后,将三颈瓶内物质经过过滤,洗涤,干燥后,得到粗产品.
①洗涤所用的试剂可以是苯;
②简述回收滤液中C6H5Cl的方案蒸馏滤液,并收集132℃馏分.
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率.若要监控氯化铁转化率达到或超过80%,则烧杯中应加入含溶质为16g且滴有酚酞的NaOH溶液(忽略滞留在装置中的气体).
7.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA | |
| B. | 标准状况下,5.6L水中含有的分子数为0.25NA | |
| C. | 20g D2O中含有的质子数目为10NA | |
| D. | 标准状况下,22.4 LCO2和O2混合气体中含有的氧原子数为2NA |
14.仪器名称为“蒸馏烧瓶”的是( )
| A. | 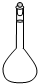 | B. | 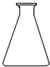 | C. | 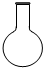 | D. | 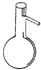 |
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.