题目内容
3.下列叙述正确的是( )| A. | 40 K和40 Ca原子中的质子数和中子数都相等 | |
| B. | 某元素最外层只有一个电子,则它一定是金属元素 | |
| C. | 任何原子或离子的组成中都含有质子 | |
| D. | 同位素的不同核素物理、化学性质完全相同 |
分析 A.元素符号的左下角数字表示质子数,左上角数字表示质量数,中子数=质量数-质子数;
B.最外层有一个电子的元素不一定是金属元素;
C.根据原子或离子的构成分析判断;
D.同位素的物理性质不同但化学性质相同.
解答 解:A.40K中质子数是19,中子数是21;40Ca中质子数是20,中子数是20,故A错误;
B.最外层有一个电子的元素不一定是金属元素,如:氢原子的最外层有一个电子,但氢是非金属元素,故B错误;
C.原子是由原子核和核外电子构成的,原子核由质子和中子构成,原子变成离子,变化的是核外电子,但核内质子不变,所以任何原子或离子的组成中都含有质子,故C正确;
D.同位素的不同核素其核外电子数相同,电子层排布相同,最外层电子决定其化学性质,所以同位素的不同核素的化学性质相同,但物理性质不同,故D错误.
故选C.
点评 本题考查了原子的构成、同位素的性质等知识点,难度不大,易错选项是B,明确最外层有一个电子的元素不一定是金属元素.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
13.电子计算器所用的纽扣式电池为银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Ag2O+Zn+H2O═Zn(OH)2+2Ag,下列叙述中正确的是( )
| A. | 电子由锌经导线流向Ag2O | |
| B. | 负极的电极反应为Zn-2e-═Zn2+ | |
| C. | 溶液中OH-向正极移动 | |
| D. | 随着电极反应的不断进行,电解质的碱性减弱 |
11.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得.有关该反应的说法正确的是( )
| A. | NaClO3在反应中失去电子 | |
| B. | Na2SO3在反应中被还原为Na2SO4 | |
| C. | 在该反应中,NaClO3和Na2SO3的物质的量之比为2:1 | |
| D. | 1 mol NaClO3参加反应有2 mol 电子转移 |
18.关于如图所示装置的叙述,不正确的是( )


| A. | 铜是正极,锌是负极 | B. | 铜片质量逐渐减少 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 铜片上有气泡产生 |
8.可逆反应达到最大反应限度的本质特征是( )
| A. | 反应停止了 | B. | 正逆反应的速率均为零 | ||
| C. | 正逆反应都还在继续进行 | D. | 正逆反应的速率相等 |
15.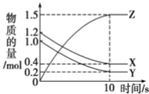 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )
 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.则从反应开始到10s末的反应速率用X表示是( )| A. | 0.08mol•L-1•s-1 | B. | 0.30mol•L-1•s-1 | C. | 0.16mol•L-1•s-1 | D. | 0.32mol•L-1•s-1 |
12.化学与社会、生活、生产密切相关.对如表现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用明矾净水 | 明矾具有杀菌消毒的作用 |
| B | 局部地区出现酸雨 | 煤、石油的燃烧产生大量CO2 |
| C | 潮湿环境中的铁制品生锈 | 铁制品中的Fe与空气中的O2直接反应生成Fe2O3 |
| D | “84”消毒液具有漂白性 | “84”消毒液中的NaClO与空气中的CO2反应生成HClO |
| A. | A | B. | B | C. | C | D. | D |
13.下列事实不能用勒夏特列原理解释的是( )
| A. | 合成氨工厂采用增大压强以提高原料的转化率 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶有气泡从溶液中冒出 | |
| D. | 2NO2(g)═N2O4(g)的平衡体系中,加压缩小体积后颜色加深用来表示可逆反应 |
 某有机物A的分子式为C4H8O2,已知A~E有下列转化关系:试回答下列问题:
某有机物A的分子式为C4H8O2,已知A~E有下列转化关系:试回答下列问题: