题目内容
16.将一定体积密度为1.84g/cm3、质量分数为98%的浓硫酸稀释成1 000mL、物质的量浓度为2mol/L的稀硫酸.求:(1)原浓硫酸的物质的量浓度;
(2)原浓硫酸的体积.
分析 (1)根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;
(2)根据稀释定律,稀释前后溶质的物质的量不变,据此计算需要浓硫酸的体积.
解答 解:(1)根据c=$\frac{1000ρω}{M}$可知,密度为1.84g/cm3、质量分数为98%的浓硫酸的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
答:该浓硫酸的物质的量浓度为18.4mol/L;
(2)设需要浓硫酸的体积为VL,根据稀释定律,稀释前后溶质的物质的量不变,则:
1L×2mol/L=V L×18.4mol/L
解得V=0.1087L
答:需要浓硫酸的体积为0.1087L.
点评 本题考查物质的量浓度有关计算,难度不大,注意对公式的理解与灵活应用,理解掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
12.下列说法不正确的是( )
| A. | 糖类、油脂、蛋白质都能发生水解反应 | |
| B. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物 | |
| D. | 油脂有油和脂肪之分,但都属于酯 |
13.将浓度为0.1mol•L-1的氨水加水不断稀释,下列各量始终保持减小的是( )
| A. | Kb(NH3•H2O) | B. | n(OH-) | C. | $\frac{{c({N{H_3}•{H_2}O})}}{{c({O{H^-}})}}$ | D. | $\frac{{c({O{H^-}})}}{{c({NH_4^+})}}$ |
4.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质.根据上述信息,下列说法不正确的是( )
| A. | Mg3N2与盐酸反应能生成两种盐 | B. | CaC2的水解产物是Ca(OH)2和C2H2 | ||
| C. | Si3N4的水解产物之一是H2SiO3 | D. | PCl5的水解产物是HClO和PH3 |
11. 一定条件下,下列各组物质能一步实现如图所示转化关系的是( )
一定条件下,下列各组物质能一步实现如图所示转化关系的是( )
 一定条件下,下列各组物质能一步实现如图所示转化关系的是( )
一定条件下,下列各组物质能一步实现如图所示转化关系的是( )| 选项 | X | Y | Z | W |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | Fe2O3 | Fe | FeCl2 | FeCl3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | NH3 | N2 | NO | NO2 |
| A. | A | B. | B | C. | C | D. | D |
8.工业上常用煤和水作原料经过多步反应制得氢气,其中一步的反应原理为:
CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g)下面选项的条件中可判断该反应达到平衡状态的是( )
CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g)下面选项的条件中可判断该反应达到平衡状态的是( )
| A. | 单位对间内消耗2mol的CO同时生成2mol的CO2 | |
| B. | 两个H-O键断裂的同时有一个H-H键断裂 | |
| C. | 反应容器内的压强不再发生变化 | |
| D. | 混合气体的相对分子质量不发生变化 |
5.若某甲原子(质子数为10)质量是a g,C-12的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 甲元素的相对原子质量一定是$\frac{12a}{b}$ | |
| B. | 该甲原子的摩尔质量是aNAg | |
| C. | Wg该甲原子的物质的量一定是Wa/(NA)mol | |
| D. | Wg该甲原子所含质子数是10W/a |
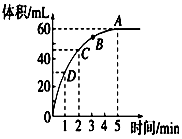 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g•mL-1),在标准状况下放出气体的体积和时间的关系如图所 示,回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g•mL-1),在标准状况下放出气体的体积和时间的关系如图所 示,回答下列问题: