题目内容
15.A、B、C、D、E为前36号元素,它们的核电荷数依次递增,已知:A是原子半径最小的元素;B原子核外有两个未成对电子,且B是形成化合物种类最多的元素;B、C、D处于同周期,C的第一电离能大于前后相邻元素;D的电负性较大,仅次于氟元素;E是前四周期中未成对电子数最多的元素.请回答下列问题:
(1)E元素原子的外围电子排布式为3d54s1,C的第一电离能大于其后面相邻元素的原因是N元素原子2p轨道为半满稳定状态,能量较低;
(2)实验测得A2D的蒸气密度比相同条件下理论值明显偏大,分析可能的原因是H2O蒸气中存在H2O分子间因氢键而形成的“缔合分子”.
(3)A、B、C形成的三原子分子中B的杂化轨道类型为sp,该分子中含有的σ键和π键的数目之比为1:1.
(4)+3价的E形成的八面体配合物ECla•bNH3,若1mol配合物与足量AgNO3溶液作用生成2molAgCl沉淀,则b=5.
分析 A、B、C、D、E为前36号元素,它们的核电荷数依次递增,A是原子半径最小的元素,则A为H元素;B原子核外有两个未成对电子,且B是形成化合物种类最多的元素,则B为碳元素;B、C、D处于同周期,即处于第二周期,C的第一电离能大于前后相邻元素,则C为N元素,D的电负性较大,仅次于氟元素,则D为O元素;E是前四周期中未成对电子数最多的元素,外围电子排布为3d54s1,则E为Cr.
解答 解:A、B、C、D、E为前36号元素,它们的核电荷数依次递增,A是原子半径最小的元素,则A为H元素;B原子核外有两个未成对电子,且B是形成化合物种类最多的元素,则B为碳元素;B、C、D处于同周期,即处于第二周期,C的第一电离能大于前后相邻元素,则C为N元素,D的电负性较大,仅次于氟元素,则D为O元素;E是前四周期中未成对电子数最多的元素,外围电子排布为3d54s1,则E为Cr.
(1)E是前四周期中未成对电子数最多的元素,外围电子排布为3d54s1,
N元素原子2p轨道为半满稳定状态,能量较低,第一电离能大于其后面相邻元素的,
故答案为:3d54s1;N元素原子2p轨道为半满稳定状态,能量较低;
(2)H2O蒸气中存在H2O分子间因氢键而形成的“缔合分子”,实验测得密度比相同条件下理论值明显偏大,
故答案为:H2O蒸气中存在H2O分子间因氢键而形成的“缔合分子”;
(3)A、B、C形成的三原子分子为HCN,结构式为H-C≡N,碳原子没有孤电子对数,杂化轨道数目为2,故碳原子采取sp杂化,该分子中含有的σ键和π键的数目之比为1:1,
故答案为:sp;1:1;
(4)+3价的Cr形成的八面体配合物CrCla•bNH3,Cr3+的配位数为6,根据化合价代数和为0,可知a=3,若1mol配合物与足量AgNO3溶液作用生成2molAgCl沉淀,说明2个氯离子为外界,1个氯离子为配体,故b=6-1=5,
故答案为:5.
点评 本题是对物质结构与性质的考查,涉及核外电子排、电离能、电负性、羟基、杂化方式判断、化学键、配合物等,注意配合物中内界与外界,同周期主族元素第一电离能异常情况.

| A. | 化合物乙中只有共价键 | |
| B. | 甲可与Z和X形成的某种化合物反应生成强酸 | |
| C. | W的氧化物只能与碱反应,不能与任何酸反应 | |
| D. | X分别与Y、Z、G、W形成的气态化合物中,稳定性最好的是XG |
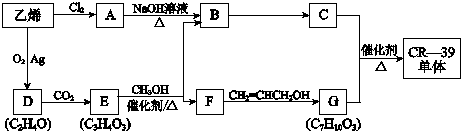
已知:i.CR-39单体结构简式是:
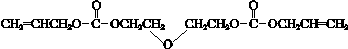
ii.酯与醇有如下反应:
RCOOR′+R″OH$→_{△}^{催化剂}$RCOOR″+R′OH(R、R′、R″代表烃基)
(1)乙烯转化为A的反应类型是加成反应.
(2)在D、E的分子中,都只有一种化学环境的氢原子.
①D的结构简式是
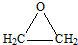 .
.②E为五元环状化合物,E与CH3OH反应的化学方程式是
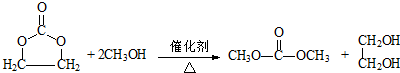 .
.(3)G与足量NaOH溶液反应的化学方程式是
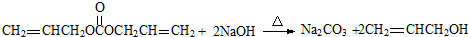 .
.(4)F的一种同分异构体K,其分子中不同化学环境的氢原子个数比是3:1:1:1,且能与NaHCO3反应.
①K能发生消去反应,生成的有机物的结构简式是
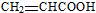 .
.②K在一定条件下合成高分子化合物的化学方程式是
 .
.(5)下列有关C的叙述正确的是(填写序号)acd.
| a.能与乙酸发生酯化反应 | b.能与乙醇发生酯化反应 |
| c.1mol C最多能与2mol Na反应 | d.C的同分异构体不能发生银镜反应 |
| A. |  的名称:2-甲基乙醇 的名称:2-甲基乙醇 | B. | 聚丙烯的链节: | ||
| C. | 甲酸甲酯的结构简式:C2H4O2 | D. | 比例模型为 的分子可发生加成反应 的分子可发生加成反应 |
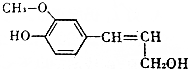 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )| A. | 该物质的分子式是C10H15O3,属于芳香族化合物 | |
| B. | 1mol该物质最多能与1molH2发生加成反应 | |
| C. | 1mol该物质只能与1molBr2反应 | |
| D. | 该物质可以与FeCl3溶液发生显色反应,也能发生酯化反应 |
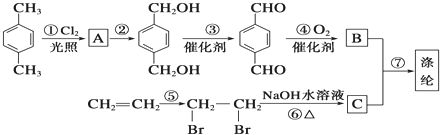
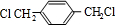 ,B
,B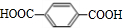 ,CHOCH2CH2OH.
,CHOCH2CH2OH. .
. 实验室发现一瓶标签破损的溶液,如图所示,同学猜想,该溶液可能是C.(填字母序号)
实验室发现一瓶标签破损的溶液,如图所示,同学猜想,该溶液可能是C.(填字母序号)