题目内容
11.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 200mL1mol/LAl2(SO4)3溶液中,Al3+和SO42-离子总数为NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
分析 A、重水的摩尔质量为20g/mol;
B、铝离子是弱碱阳离子,在溶液中会水解;
C、过氧化钠与水的反应中,氧元素的价态由-1价变为0价;
D、NO2和N2O4之间存在转化,方程式2NO2?N2O4;
解答 解:A、重水的摩尔质量为20g/mol,故18g重水的物质的量为n=$\frac{18g}{20g/mol}$=0.9mol,而重水中含10个质子,故0.9mol重水中含9mol质子即9NA个,故A错误;
B、铝离子是弱碱阳离子,在溶液中会水解,故溶液中的铝离子和硫酸根的总数小于NA个,故B错误;
C、过氧化钠与水的反应中,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故C正确;
D、NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4,所以产物分子数小于2NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
1.在通常情况下呈黄绿色的气体是( )
| A. | NO2 | B. | NO | C. | Cl2 | D. | SO2 |
2.下列实验方案设计中,可行的是( )
| A. | 加稀硝酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| C. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 | |
| D. | 用澄清石灰水试液鉴别SO2和CO2两种气体 |
6.工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如图:
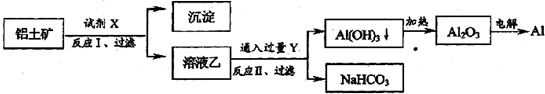
对上述流程中的判断正确的是( )

对上述流程中的判断正确的是( )
| A. | 试剂X为稀硫酸 | |
| B. | 反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| C. | 结合质子( H+)的能力由强到弱的顺序是:OH->HCO3->AlO2- | |
| D. | Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
16.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Na+ | |
| B. | 水电离出的c(H+)=10-12mol•L-1的溶液中:Ca2+、K+、Cl-、HCO${\;}_{3}^{-}$ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的水溶液中:NH${\;}_{4}^{+}$、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO${\;}_{4}^{2-}$、SCN- |
3.下列对于“摩尔”的理解正确的是( )
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,12C碳-12原子所含有的碳原子数目的物质的量为1摩 |
1. 在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0; t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程(I、Ⅱ)如图所示.下列说法中,一定不正确的是( )
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0; t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程(I、Ⅱ)如图所示.下列说法中,一定不正确的是( )
 在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0; t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程(I、Ⅱ)如图所示.下列说法中,一定不正确的是( )
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0; t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程(I、Ⅱ)如图所示.下列说法中,一定不正确的是( )| A. | 0~t1时,V正>V逆 | |
| B. | I、Ⅱ两过程分别达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| C. | t2时刻改变的条件可能是向密闭容器中加C物质 | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ=Ⅱ |