题目内容
1. 已知氮化铝的晶胞结构如图所示.请回答下列问题:
已知氮化铝的晶胞结构如图所示.请回答下列问题:(1)NH3空间构型为三角锥型;
(2)若氮化铝可由(CH3)3Al和NH3在一定条件下反应制得,则反应的方程式为(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4.
(3)若Al与N 原子最近的距离为a cm,则该晶体的密度为$\frac{41×3\sqrt{3}}{16{a}^{3}{N}_{A}}$g.cm-3.(阿伏加德罗常数用NA表示)
分析 (1)根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数;
(2)晶胞中晶胞中N原子数目为4、Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氮化铝化学式为AlN,可由(CH3)3Al和NH3在一定条件下反应制得,由元素守恒可知还生成甲烷;
(3)顶点白色与相邻的黑色球位于晶胞体对角线上,黑色球到侧面距离均相等,过晶胞中左侧2个黑色球、右侧2个黑色球及面心白色球作左、右侧面的平行面,可以将体对角线4等份,即顶点白色球与相邻黑色球距离为晶胞体对角线的$\frac{1}{4}$,据此计算晶胞棱长,进而计算晶胞体积.利用均摊法计算晶胞中Al、N原子数目,进而计算晶胞质量,再根据ρ=$\frac{m}{ρ}$计算晶胞密度.
解答 解:(1)氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,且含有一个孤电子对,所以其空间构型为三角锥型,
故答案为:三角锥型;
(2)晶胞中晶胞中N原子数目为4、Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氮化铝化学式为AlN,可由(CH3)3Al和NH3在一定条件下反应制得,由元素守恒可知还生成甲烷,反应方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,
故答案为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ;
(3)顶点白色与相邻的黑色球位于晶胞体对角线上,黑色球到侧面距离均相等,过晶胞中左侧2个黑色球、右侧2个黑色球及面心白色球作左、右侧面的平行面,可以将体对角线4等份,即顶点白色球与相邻黑色球距离为晶胞体对角线的$\frac{1}{4}$,则晶胞体对角线长为4acm,晶胞棱长为$\frac{4\sqrt{3}a}{3}$cm,晶胞中N原子数目为4、Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量为4×$\frac{41}{{N}_{A}}$g,则晶胞密度为4×$\frac{41}{{N}_{A}}$g÷($\frac{4\sqrt{3}a}{3}$cm)3=$\frac{41×3\sqrt{3}}{16{a}^{3}{N}_{A}}$g.cm-3,
故答案为:$\frac{41×3\sqrt{3}}{16{a}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,涉及杂化方式、方程式书写、晶胞计算等,(3)中计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力,题目难度中等.

 LiOH是制备锂离子电池的材料,可由电解法制备.工业上利用如图装置电解制备 LiOH,两电极区电解 液分别为LiOH和LiCl溶液( )
LiOH是制备锂离子电池的材料,可由电解法制备.工业上利用如图装置电解制备 LiOH,两电极区电解 液分别为LiOH和LiCl溶液( )| A. | B极区电解液为LiOH溶液 | |
| B. | 电极每产生22.4L气体,电路中转移2mole- | |
| C. | 电解过程中Li+迁移入B电极区、OH-迁移入A电极区 | |
| D. | 电解池中总反应方程式为:2HCl$\frac{\underline{\;通电\;}}{\;}$2H2↑+Cl2↑ |
| A. | H+、Ca2+、Fe3+、NO3- | B. | Na+、CO32-、NH4+、Cl- | ||
| C. | Na+、K+、I-、OH- | D. | NH4+、K+、Cl-、SO42- |
| A. | 无色溶液中:K+、Cu2+、OH-、NO3- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、I-、SCN- | |
| C. | pH=12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=1×10-12mol•L-1的溶液中:K+、Na+、Cl-、NO3- |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 二 | ① | |||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ |
(2)元素②与⑥形成的BA型化合物所含的化学键类型为:离子键.
(3)元素④的单质制造的器具不能盛装碱性溶液也不能盛装酸性溶液,请写出元素④的单质与氢氧化钠溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)设计实验证明:元素①比元素⑤的非金属性强:向盛有少量Na2SiO3溶液的试管里通入CO2气体,有白色胶状沉淀产生.
| A. | 100 g 98%的浓硫酸中含氧原予总数为4NA | |
| B. | 常温常压下,18g重水(D2O)中所含的电子数为10 NA | |
| C. | 常温常压下,4.6 g NO2气体含有0.3 NA个原子 | |
| D. | 常温下,2.7g、铝片投入足量的浓硫酸中,产生的SO2,分子数为0.3NA |
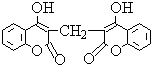 某农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.化学家由此得到启发,从腐败草料中提取出结构简式为如图所示的双香豆素.下列关于双香豆素的推论中错误的是( )
某农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.化学家由此得到启发,从腐败草料中提取出结构简式为如图所示的双香豆素.下列关于双香豆素的推论中错误的是( )| A. | 有望将它发展制得一种抗凝血药 | |
| B. | 它无嗅并略具芳香味,因而可用来制备致命性出血型的杀鼠药 | |
| C. | 它可由化合物和甲醛(HCHO)通过缩合反应制得 | |
| D. | 它与足量NaOH溶液反应,消耗NaOH 6mol |
| 选项 | 方法 | 对相应方法的描述 |
| A | 改变金属内部的组成结构 | 此法实际上是将金属制成合金,增强抗腐蚀能力 |
| B | 在金属表面覆盖保护层 | 保护层破损后,就完全失去了对金属的保护作用 |
| C | 外加电流的阴极保护法 | 接外加直流电源构成电解池,被保护的金属作阴极 |
| D | 牺牲阳极的阴极保护法 | 构成原电池,被保护的金属作正极 |
| A. | A | B. | B | C. | C | D. | D |