题目内容
4.已知1mol某气体X分子中含有1mol C原子,4mol H原子,则X的化学式为CH4.分析 由n=$\frac{N}{{N}_{A}}$可知分子由、原子个数的比值等于物质的量之比,以此解答该题,
解答 解:1mol某气体X分子中含有1mol C原子,4mol H原子,则X分子中含有1个C、4个H原子,分子式为CH4,
故答案为:CH4.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的构成特点,难度不大.

练习册系列答案
相关题目
6.下列离子方程式书写正确的是( )
| A. | 碳酸钙溶于稀硝酸:CO32-+2H+→CO2↑+H2O | |
| B. | 氯化铜溶液中加入NaHS溶液:Cu2++HS-=CuS↓+H+ | |
| C. | 碳酸钠溶液中通入少量二氧化碳:CO32-+CO2+H2O=2HCO3- | |
| D. | 硫酸氢铵溶液中加入少量氢氧化钠溶液:NH4++OH-→NH3↑+H2O |
7.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
下列说法或表达正确的是( )
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | 2NaClO+CO2+H2O→Na2CO3+2HClO | |
| B. | HCN+Na2CO3→NaHCO3+NaCN | |
| C. | 结合质子能力由强到弱的顺序为:CO32->HCO3->CH3COO- | |
| D. | 常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN) |
12.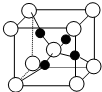 硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
(1)测定蓝矾属于晶体的物理方法是X-射线衍射.其中SO42-中S原子的轨道杂化形式是sp3;H2O的空间构型是V形.
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是CuSO4(化学式);A溶于水配成溶液,加入氨水,观察到的现象是首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;最终得到溶液中的含铜元素的离子是[Cu(NH3)4]2+(化学式),该离子含有的化学键类型有配位键、极性键.
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是1s22s22p63s22p63d10;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子).
①该温度是1000℃以上.
②铜原子的配位数是2.
③已知该晶体的密度为dg•cm-3,则晶胞参数是$\root{3}{\frac{288}{{N}_{A}d}}$×1010pm.
 硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是CuSO4(化学式);A溶于水配成溶液,加入氨水,观察到的现象是首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;最终得到溶液中的含铜元素的离子是[Cu(NH3)4]2+(化学式),该离子含有的化学键类型有配位键、极性键.
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是1s22s22p63s22p63d10;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子).
①该温度是1000℃以上.
②铜原子的配位数是2.
③已知该晶体的密度为dg•cm-3,则晶胞参数是$\root{3}{\frac{288}{{N}_{A}d}}$×1010pm.
9.下列有关说法不正确的是( )
| A. | 少量金属钠保存在煤油中 | |
| B. | 烧碱溶液盛装在带有玻璃塞的试剂瓶中 | |
| C. | 含有Fe3+的盐溶液遇KSCN 溶液变红 | |
| D. | 明矾(KAl(SO4)2•12H2O)可用作净水剂 |
16.下列各分子中所有原子都满足最外层为8电子结构的是( )
| A. | N2 | B. | BF3 | C. | PCl5 | D. | HCl |
14.实验室配制氯化铁溶液时,把氯化铁溶解在稀盐酸中.这样操作的目的是( )
| A. | 加快氯化铁的溶解 | B. | 提高溶液的pH | ||
| C. | 抑制氯化铁的水解 | D. | 增大氯化铁的溶解度 |

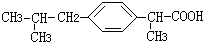
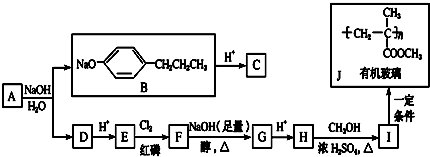
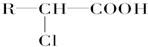 +HCl
+HCl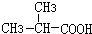 、G
、G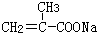 .
.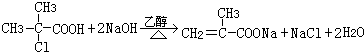 ;H→I
;H→I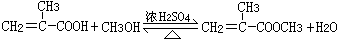 .
.