��Ŀ����
10������ͭ��һ��Ӧ�ü���㷺�Ļ���ԭ�ϣ����ò�ͬ�ķ����Ƶ�����ͭ��I��������Ũ����ֶ�μӵ�ͭ����ϡ����Ļ�����У�����ʹ֮��Ӧ��ȫ��ͨ���� �����ᾧ�õ�����ͭ���壨װ����ͼ1��2��
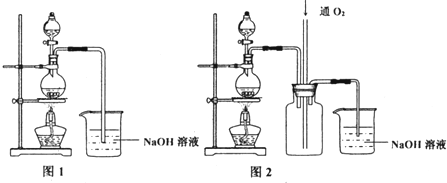
��1��ͼ1��Һ©����װ��Һ����Ũ���ᣮ
��2��ͼ2��ͼ1�ĸĽ�װ�ã���ͼح��ȣ�ͼ2װ�õ������ŵ��Ƿ�ֹ�������к������ܱ���ȫ����
II��Ϊ������ɫ��ѧ��Ҫ��ij�о���ѧϰС�����������ƣ�
����1����ͭ���������з������գ��������ַ�Ӧ��������ͭ���ٽ�����ͭ��ϡ���ᷴӦ��
����2������������������ͨ��ͭ����ϡ����Ļ��������ͬʱ��ӦҺ�еμ����� FeSO4��Fe2��SO4��3����������Ӧ����Ӧ��ȫ���CuCO3����PH��3〜4������Fe��OH��3������Ȼ����ˡ��������ᾧ�ɵ�CuS04.5H20������Ķѭ��ʹ�ã�
��3�������ӷ���ʽ��ʾ����FeS04��Fe2��SO4��3������������Ӧ��2Fe3++Cu=2Fe2++Cu2+��4Fe2++O2+4H+=4Fe3++2H2O
����3��������ͭ˿�ŵ�������ϡ�����У��¶ȿ�����500C������H2O2����Ӧһ�΅� ������µ�600C���ٷ�Ӧһ��ʱ���Ȼ����ˡ��������ᾧ�����þ���������95%�� �ƾ���ϴ�����ɣ���CuSO4��5H2O��
��4������������95%�ľƾ���ϴ��Ŀ���dz�ȥ����ͭ����������ʣ�����ͭ�ھƾ����ܽ�Ƚ�С���þƾ���ϴ�ɼ�������ͭ������ʧ����Ҫ�õ�25.0g����ͭ���壬������Ҫ30%���ܶ�Ϊ1.1g/cm3����H2O210.30ml��
���� ��1���������⽫����Ũ����ֶ�μӵ�ͭ����ϡ����Ļ�����У���Һ©����ӦΪŨ���
��2��Ũ������ͭ��Ӧ������ԭ���ɶ�������������Ũ�ȵĽ��ͣ���NO���ɣ�ͼ2���м��װ�ÿɷ�ֹ�������������������������ķ�Ӧ��ʹ�õ�����������ȫ���գ�
��3����ӦҺ�м�FeS04��Fe2��SO4��3ʱ��Fe2��SO4��3��Cu��Ӧ����FeSO4���������ӱ���������Ϊ�����ӣ�
��4������ͭ�ھƾ����ܽ�Ƚ�С�����ݷ�ӦH2O2+Cu+H2SO4=2H2O+CuSO4�������Ҫ�õ�25.0g����ͭ���壬������Ҫ30%��H2O2 ��������������$V=\frac{m}{��}$���㣻
��� �⣺��1���ɽ�����Ũ����ֶ�μӵ�ͭ����ϡ����Ļ�����п�֪����Һ©����ӦΪŨ���ᣬ
�ʴ�Ϊ��Ũ���
��2����װ�ñȽϿ�֪��װ��2�ж����װ����ʹ��Һ�뵼�ܲ�ֱ�ӽӴ�����ֹ������ͬʱNO���������Ӧ��ʹ�к������ܱ���ȫ���գ�
�ʴ�Ϊ����ֹ�������к������ܱ���ȫ���գ�
��3����ӦҺ�м�FeS04��Fe2��SO4��3��Fe2��SO4��3��Cu��Ӧ����FeSO4���䷴Ӧ�����ӷ���ʽΪ��2Fe3++Cu=2Fe2++Cu2+��ͨ��������ܹ���������������Ϊ�����ӣ��䷴Ӧ�����ӷ���ʽΪ��4Fe2++O2+4H+=4Fe3++2H2O��
�ʴ�Ϊ��2Fe3++Cu=2Fe2++Cu2+��4Fe2++O2+4H+=4Fe3++2H2O��
��4������ͭ�ھƾ����ܽ�Ƚ�С������������95%�ľƾ���ϴCuSO4��5H2O���壬�ȿɳ�ȥ����ͭ����������ʣ��ֿɼ�������ͭ������ʧ��
��Ҫ�õ�25.0g����ͭ���壬������Ҫ30%��H2O2 ������Ϊxg��
���ݷ�ӦH2O2+Cu+H2SO4=2H2O+CuSO4��
34 160
30%x $\frac{160}{250}��25$
����x=11.33g��
�ʿ����H2O2 �����Ϊ$\frac{11.33g}{1.1g/c{m}^{3}}$=10.30mL��
�ʴ�Ϊ����ȥ����ͭ����������ʣ�����ͭ�ھƾ����ܽ�Ƚ�С���þƾ���ϴ�ɼ�������ͭ������ʧ��10.30��
���� ���⿼����ѧ����ʵ��ԭ�������⡢ʵ�鷽�������ۡ�ʵ��װ�õ����������ۡ����ӷ���ʽ����д����ѧ����ȣ��Ѷ��еȣ�������ע�����֪ʶ��������ã�

| �鷽�� | ������ | ��ɫ�� | ���巨 |
| �жϵ����� | ��Ӧ���г����������ܽ� | ��Ӧ������ɫ�仯 | ��Ӧ����������� |
| A�� | CO32---���巨 | B�� | SO42---������ | C�� | H+--��ɫ�� | D�� | Cl---���巨 |
| A�� | �����£�Ũ�Ⱦ�Ϊ0.2mol•L-1��NaHCO3��Na2CO3��Һ�У������ڵ���ƽ���ˮ��ƽ�⣬�ֱ����NaOH����ָ���ԭ�����¶ȣ�c��CO32- �������� | |
| B�� | ��֪���ᣨHA�������Աȼ��ᣨHB�����������ʵ���Ũ�Ⱦ�Ϊ0.1 mol•L-1��NaA��NaB�����Һ�У�c��Na+����c��B-����c��A-����c�� OH-����c��HA����c��HB����c��H+�� | |
| C�� | pH��ͬ��CH3COONa��Һ��C6H5ONa��Һ��Na2CO3��Һ��NaOH��Һ����Ũ�ȣ�c��CH3COONa����c��C6H5ONa����c�� Na2CO3����c��NaOH�� | |
| D�� | һ���¶��£�pH��ͬ����Һ����ˮ���������c��H+����ͬ |
I����֪��ӦFe2O3��s��+CO��g��?Fe��s��+CO2��g����H=-23.5kJ•mol-1���÷�Ӧ��1000���ƽ�ⳣ������4����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol��Ӧ����l0min��ﵽƽ�⣮
��1��CO��ƽ��ת����=60%
��2�������CO��ƽ��ת���ʣ��ٽ�Fe2O3��ת�����ɲ�ȡ�Ĵ�ʩ��d��
a����߷�Ӧ�¶�
b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ���
d����ʱ���ջ��Ƴ�����CO2
e�������ʯ��ʹ����ƽ���������ֽӴ�
��¯���������ķ����е�CO�ɽ��л��գ�ʹ����һ�������º�H2��Ӧ�Ʊ��״���CO��g��+2H2��g��?CH3OH��g���������ͼʾ�ش��������⣺

��3���ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v��H2��=0.15mol/��L•min����
��4����֪������ȼ����286kJ/mol����д���״����岻���ȼ�յ��Ȼ�ѧ����ʽCH3OH��g��+O2��g��=2H2O��l��+CO��g����H=-481kJ/mol��
��5�������¶Ⱥ�������ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
| ���� | ��Ӧ��Ͷ����� | ��Ӧ��� ת���� | CH3OH��Ũ�� | �����仯 ��Q1��Q2��Q3������0�� |
| �� | 1mol CO��2mol H2 | ��1 | c1 | �ų�Q1kJ���� |
| �� | 1mol CH3OH | ��2 | c2 | ����Q2kJ���� |
| �� | 2mol CO��4mol H2 | ��3 | c3 | �ų�Q3kJ���� |
A��c1=c2B.2Q1=Q3C.2��1=��3D����1+��2=1E���÷�Ӧ������1mol CH3OH����ų���Q1+Q2��kJ����
���Լ���Ϊȼ�ϵ����͵�أ���ɱ�����������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ�Ŀǰ�õ��㷺���о�����ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ���ش��������⣺

��6��B���ϵĵ缫��ӦʽΪCH4-8e-+4O2-=CO2+2H2O��
��7�����ø�ȼ�ϵ������Դ����ʯī���缫���100mL 1mol/L������ͭ��Һ���������ռ���������������ʱ�����������ĵļ�������Ϊ1.12L������£���
 ��֪�Ȼ�ѧ����ʽH+��aq��+OH-��aq���TH2O��l����H=-57.3kJ/mol��
��֪�Ȼ�ѧ����ʽH+��aq��+OH-��aq���TH2O��l����H=-57.3kJ/mol��

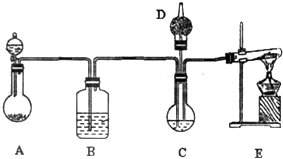 ����̼����й㷺��Ӧ��ǰ��������ͼ��ʾװ�ã���ŨCaCl2��Һ��ͨ��NH3��CO2���Ƶ�����̼��ƣ�D��װ��պϡ�������֬�ޣ�ͼ�мг�װ������ȥ��
����̼����й㷺��Ӧ��ǰ��������ͼ��ʾװ�ã���ŨCaCl2��Һ��ͨ��NH3��CO2���Ƶ�����̼��ƣ�D��װ��պϡ�������֬�ޣ�ͼ�мг�װ������ȥ��
 ��2-������
��2-������ ��
��