题目内容
15.25℃时,现有浓度均为0.10mol•L-1的两种溶液:①CH3COOH溶液、②NaOH溶液.请回答:(1)将等体积①和②混合,所得溶液显碱 (填“酸”“碱”或“中”)性,原因是CH3COO-+H2O?CH3COOH+OH- (用离子方程式表示).
(2)向①中逐滴加入②至所得溶液pH=7的过程中(不含pH=7时的溶液),下列关系正确的是abd
a.c(H+)>c(OH- ) b.c(OH-)+c(CH3COO-)=c(H+ )+c(Na+ )
c.c(Na+)=c(CH3COO-)+c(CH3COOH) d.c(Na+)<c(CH3COO- )
分析 (1)将等体积①和②混合,CH3COOH溶液和NaOH溶液恰好反应生成醋酸钠溶液,溶液中醋酸根离子水解溶液显碱性;
(2)向①中逐滴加入②至所得溶液pH=7的过程中,开始醋酸多溶液显酸性,滴入氢氧化钠溶液至呈中性,醋酸略过量,得到醋酸和醋酸钠的混合溶液,恰好反应生成醋酸钠后溶液显碱性,溶液中存在物料守恒和电荷守恒.
解答 解:(1)将等体积①和②混合,CH3COOH溶液和NaOH溶液恰好反应生成醋酸钠溶液,溶液中醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,
故答案为:碱; CH3COO-+H2O?CH3COOH+OH-;
(2)向①中逐滴加入②至所得溶液pH=7的过程中,
a.开始阶段醋酸过量,溶液显酸性,c(H+)>c(OH-),故a正确;
b.开始阶段生成醋酸钠少,醋酸多,溶液显酸性,c(H+)>c(OH-),溶液中存在电荷守恒:c(OH-)+c(CH3COO-)=c(H+)+c(Na+),得到c(Na+)<c(CH3COO-),故b正确;
c.溶液中恰好完全反应生成醋酸钠溶液中存在守恒,c(Na+)=c(CH3COO-)+c(CH3COOH),但滴定过程溶液pH=7前,是醋酸始终过量,c(Na+)<c(CH3COO-)+c(CH3COOH),故c错误;
d.溶液中始终存在电荷守恒:c(OH-)+c(CH3COO-)=c(H+)+c(Na+),故d正确,
故答案为:abd.
点评 本题考查了溶液酸碱性与溶液pH的计算、离子浓度大小比较,题目难度不大,明确电荷守恒、盐的水解原理的含义为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
5.给150mL某液体加热的操作中,所需的仪器是( )
①试管;②烧杯;③酒精灯;④试管夹;⑤石棉网;⑥泥三角;⑦坩埚;⑧三脚架.
①试管;②烧杯;③酒精灯;④试管夹;⑤石棉网;⑥泥三角;⑦坩埚;⑧三脚架.
| A. | ③⑥⑦⑧ | B. | ②③⑤⑧ | C. | ①③④⑤ | D. | ②③⑤⑥ |
6.以下反应中,Q1>Q2的是(Q指反应放出的热量)( )
| A. | S(s)+O2(g)→SO2(g) Q1 kJ; S(g)+O2(g)→SO2(g) Q2 kJ | |
| B. | 2H2(g)+O2(g)→2H2O(g) Q1kJ; 2H2(g)+O2(g)→2H2O(l) Q2kJ | |
| C. | NaOH(aq)+HCl(aq)→NaCl(aq)+H2O(l) Q1kJ; NaOH(aq)+CH3COOH(aq)→CH3COONa(aq)+H2O(l) Q2 kJ | |
| D. | H2(g)+Cl2(g)→2HCl(g) Q1kJ; H2(g)+F2(g)→2HF(g) Q2kJ |
3.下列离子方程式与所述事实相符且正确的是( )
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用FeCl3溶液腐蚀铜板制印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 向NaAlO2溶液中通入少量CO2制Al(OH)3:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓ | |
| D. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
10.向混合溶液甲中缓慢滴加溶液乙,反应生成沉淀的质量如图所示,其中可能符合图象的一组是( )
| 甲 | 乙 | 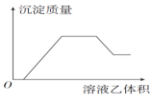 | |
| A | NH4NO3、Al(NO3)3、HCl、Fe(NO3)3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| D | NaAlO2、NH3•H2O、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
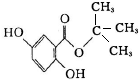
20.乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
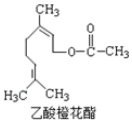

| A. | 分子式为 C12H22O2 | |
| B. | 1mol 该有机物水解时只能消耗 1 mol NaOH | |
| C. | 能使酸性 KMnO4溶液褪色,能发生加成反应,但不能发生取代反应 | |
| D. | 1mol 该有机物在一定条件下和 H2反应,共消耗 H2 为 3mol |
7.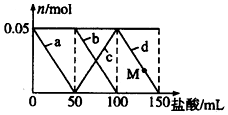 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3 | |
| B. | b和c曲线表示的离子反应是相同的 | |
| C. | M点时Al(OH)3的质量小于3.9g | |
| D. | 原混合溶液中的CO32-与AlO2-的物质的量之比为2:1 |
4.下列说法中正确的是( )
| A. | 1mol任何物质都含有6.02×1023个分子 | |
| B. | 在相同条件下,相同物质的量CO、N2的混合气体与O2的分子个数相同,原子个数也相同 | |
| C. | NaOH的摩尔质量40g | |
| D. | 在标准状况下,1molO2与1molSO3的体积相同 |
 .
.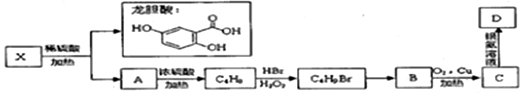
 ,C4H9Br→B的化学反应是取代反应.
,C4H9Br→B的化学反应是取代反应. .
.