题目内容
2.4.80g金属镁溶解于100mL5.0mol/L的HNO3溶液中正好完全反应,则HNO3的还原产物可能是( )| A. | NO | B. | N2O | C. | NO2 | D. | NH4NO3 |
分析 n(Mg)=$\frac{4.80g}{24g/mol}$=0.2mol,n(HNO3)=0.1L×5mol/L=0.5mol,反应生成0.2molMg(NO3)2,0.4molHNO3表现酸性,此时存在两种可能性,①0.1molHNO3都表现氧化性,结合电子守恒计算即可,
②0.1molHNO3是既表现氧化性也表现酸性.
解答 解:n(Mg)=$\frac{4.80g}{24g/mol}$=0.2mol,n(HNO3)=0.1L×5mol/L=0.5mol,反应生成0.2molMg(NO3)2,0.4molHNO3表现酸性,此时存在两种可能性,
①0.1molHNO3都表现氧化性,设HNO3的还原产物中N的化合价是x,
根据得失电子守恒,0.2mol×2=0.1mol×(5-x),解得x=1,所以HNO3的还原产物中N元素是+1价,因此N2O正确;
②0.1molHNO3是既表现氧化性也表现酸性,因此NH4NO3符合,
故选BD.
点评 本题考查学生氧化还原反应中电子守恒的计算知识,注意知识的归纳和迁移应用是关键,难度中等.

练习册系列答案
相关题目
14.证明某溶液只含有Fe2+而不含有Fe3+的最佳实验操作是( )
| A. | 只需加KSCN溶液 | B. | 只需加NaOH溶液 | ||
| C. | 先加KSCN溶液,再加氯水 | D. | 先加氯水,再加KSCN溶液 |
11.25℃时,下列有关溶液中各微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L的NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol/L的CH3COOH溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | pH=4的FeCl3溶液:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) | |
| D. | pH=11的CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH) |
7.几种短周期元素的原子半径及主要化合价如下表所示:
下列说法中正确的是( )
| 元素符号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5,+3,-3 | -2 |
| A. | 一定条件下,Z的单质与W的常见单质直接生成ZW2 | |
| B. | Z最高价氧化物对应水化物与其氢化物能发生化合反应生成离子化合物 | |
| C. | Y的最高价氧化物对应水化物溶于氨水 | |
| D. | 相同条件下,X,Y的单质分别与盐酸反应时,后者反应剧烈些 |
 N2O4(g),△H<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的
N2O4(g),△H<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的 关系图。下列示意图中,可能与实验结果相符的是( )
关系图。下列示意图中,可能与实验结果相符的是( )
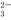 、S
、S O
O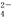 三种离子,如果只取一次该溶
三种离子,如果只取一次该溶 液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)____________、______________、____________。
液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)____________、______________、____________。