题目内容
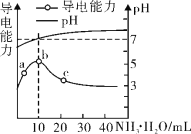
【题目】常温下,向10 mL 0.1 mol/L的HR溶液中逐滴滴入0.l mol/L 的氨水,溶液pH及导电性变化如图。
下列分析正确的是
A.HR为强酸
B.加入10 mL 氨水时,溶液中c(NH4+)>c(R-)
C.c点溶液存在c(NH4+)<c( R-)
D.b点的离子浓度大于a点的离子浓度
【答案】D
【解析】
A. a~b点导电能力增强,说明反应后溶液中离子浓度增大,证明HR在溶液中部分电离,为弱酸,故A错误;
B. 根据图象可知b点溶液pH=7,此时HR与一水合氨的物质的量相等,二者恰好反应生成NH4R,c(H+)=c(OH-)时,根据电荷守恒得,溶液中c(NH4+)=c(R-),故B错误;
C. 根据图象可知,c点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-),故C错误;
D. 溶液的导电能力与离子浓度有关,b点导电能力强,说明b点的离子浓度大于a点的离子浓度,故D正确;
故选D。

练习册系列答案
相关题目
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大