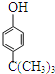
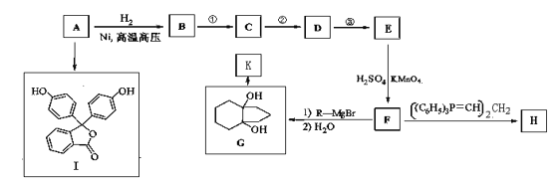
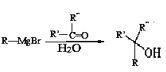
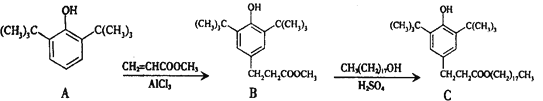
题目内容
【题目】利用食盐水制取ClO2的工业流程如图所示。

装置①中的反应:![]()
装置②中的反应:![]()
下列关于该流程的说法正确的是
A.该流程中仅NaCl可循环利用
B.装置①中H2是阴极产物
C.装置②中Cl2是还原产物
D.为使H2完全转化为HCl,还应向装置③中再补充Cl2
【答案】BD
【解析】
A. 电解食盐水得到氢气、氯气和氢氧化纳溶液,氢气和氯气反应生成氯化氢得到浓盐酸,制得NaClO3和浓盐酸加热反应生成ClO2,![]() ,该流程中Cl2、NaCl都可以循环利用,故A错误;
,该流程中Cl2、NaCl都可以循环利用,故A错误;
B. 装置①是电解食盐水,溶液中氢离子在阴极得到电子生成氢气,是阴极产物,故B正确;
C. ![]() 反应中,氯气中的氯来自HCl中的氯,所以氯气是氧化产物,故C错误;
反应中,氯气中的氯来自HCl中的氯,所以氯气是氧化产物,故C错误;
D. 根据装置①和装置②中反应的关系可知,生成HCl时Cl2少量,为了使H2完全转化为HCl,需要向装置③中补充Cl2,故D正确;
故选BD。

【题目】铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:
![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :
Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :
温度/℃ | 1000 | 1115 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=______;Q______0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正___υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=______;
(3)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有____________、____________;
4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有____________、____________;
(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如下图所示:
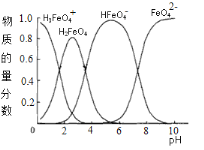
(i)pH=2时溶液存在如下等量关系: c(K+)=_____________;
(ii)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为_________。