题目内容
现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构.已知:
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G
P
Q
M+P
④E和D是同主族元素,氢化物(H2E)常温下为气态.
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)C元素在周期表的位置 ;M为 化合物(填“离子”或“共价”)
(2)A元素的离子结构示意图是 ;化合物X所含化学键类型有 .
(3)A的氧化物与NaOH反应的化学方程式为 .
(4)E的非金属性比F (填“强”或“弱”),并用化学事实加以说明(用化学方程式表示) .
(5)根据同主族元素性质的相似性和递变性进行预测:关于Se的预测正确的是
A.常温下Se单质是气体 B.Se最高价氧化物的水化物能和NaOH发生反应
C.氢化物的化学式为H2Se D.常见的氧化物只有SeO3.
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G
| D的单质 |
| D的单质 |
| H2O |
④E和D是同主族元素,氢化物(H2E)常温下为气态.
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)C元素在周期表的位置
(2)A元素的离子结构示意图是
(3)A的氧化物与NaOH反应的化学方程式为
(4)E的非金属性比F
(5)根据同主族元素性质的相似性和递变性进行预测:关于Se的预测正确的是
A.常温下Se单质是气体 B.Se最高价氧化物的水化物能和NaOH发生反应
C.氢化物的化学式为H2Se D.常见的氧化物只有SeO3.
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,核外电子数相等,
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,则F是Cl元素;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化::G
P
Q
M+P,则C是N元素,D为氧元素,G为氨气、P为NO、Q为二氧化氮,M为硝酸;
④E和D是同主族元素,氢化物(H2E)常温下为气态,则E是S元素;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,X为Na2O2、Y为Na2O.
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,则F是Cl元素;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化::G
| D的单质 |
| D的单质 |
| H2O |
④E和D是同主族元素,氢化物(H2E)常温下为气态,则E是S元素;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,X为Na2O2、Y为Na2O.
解答:
解:A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,核外电子数相等,
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,则F是Cl元素;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化::G
P
Q
M+P,则C是N元素,D为氧元素,G为氨气、P为NO、Q为二氧化氮,M为硝酸;
④E和D是同主族元素,氢化物(H2E)常温下为气态,则E是S元素;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,X为Na2O2、Y为Na2O,
(1)C为氮元素,元素在周期表的位置为第二周期第ⅤA;M为硝酸,属于共价化合物,
故答案为:第二周期第ⅤA;共价;
(2)A为Al元素,其离子结构示意图是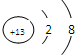 ;化合物X为Na2O2,所含化学键有离子键、共价键,
;化合物X为Na2O2,所含化学键有离子键、共价键,
故答案为: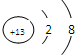 ;离子键、共价键;
;离子键、共价键;
(3)A的氧化物为氧化铝,与NaOH反应生成偏铝酸钠与水,反应化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(4)硫和氯元素处于同一周期,随着原子序数的增大非金属性增强,故硫的非金属性比氯元素弱,氯气和硫化氢能发生置换反应,可以证明氯元素非金属性比硫强,反应方程式为:H2S+Cl2=S↓+2HCl(其他合理答案也可),
故答案为:弱;H2S+Cl2=S↓+2HCl(其他合理答案也可);
(5)A.Se单质为分子晶体,相对分子质量大于硫,常温下Se单质是固体,故A错误;
B.Se与S的最高价氧化物的水化物性质相似,都属于酸性,能和NaOH发生反应,故B正确;
C.Se与S的最大负化合价都是-2,氢化物的化学式为H2Se,故C正确;
D.Se与S的性质相似,有+4、+6价,常见的氧化物有SeO2、SeO3,故D错误,
故答案为:BC.
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,则F是Cl元素;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化::G
| D的单质 |
| D的单质 |
| H2O |
④E和D是同主族元素,氢化物(H2E)常温下为气态,则E是S元素;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,X为Na2O2、Y为Na2O,
(1)C为氮元素,元素在周期表的位置为第二周期第ⅤA;M为硝酸,属于共价化合物,
故答案为:第二周期第ⅤA;共价;
(2)A为Al元素,其离子结构示意图是
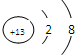 ;化合物X为Na2O2,所含化学键有离子键、共价键,
;化合物X为Na2O2,所含化学键有离子键、共价键,故答案为:
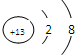 ;离子键、共价键;
;离子键、共价键;(3)A的氧化物为氧化铝,与NaOH反应生成偏铝酸钠与水,反应化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(4)硫和氯元素处于同一周期,随着原子序数的增大非金属性增强,故硫的非金属性比氯元素弱,氯气和硫化氢能发生置换反应,可以证明氯元素非金属性比硫强,反应方程式为:H2S+Cl2=S↓+2HCl(其他合理答案也可),
故答案为:弱;H2S+Cl2=S↓+2HCl(其他合理答案也可);
(5)A.Se单质为分子晶体,相对分子质量大于硫,常温下Se单质是固体,故A错误;
B.Se与S的最高价氧化物的水化物性质相似,都属于酸性,能和NaOH发生反应,故B正确;
C.Se与S的最大负化合价都是-2,氢化物的化学式为H2Se,故C正确;
D.Se与S的性质相似,有+4、+6价,常见的氧化物有SeO2、SeO3,故D错误,
故答案为:BC.
点评:本题考查了元素化合物的性质,正确推断元素是解本题关键,注意掌握元素周期律,(5)中注意根据同主族元素化合物性质的相似性解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是(NA为阿伏加德罗常数)( )
| A、在1mol甲基(-CH3)中,电子总数9NA |
| B、在78g的Na2O2中,有2NA个阴离子 |
| C、标准状况下,22.4L CHC13所含有的分子数目为NA |
| D、Cu、A1为电极,浓硝酸为电解质溶液所构成的原电池中,导线上流过NA个电子,则A1电极放出气体的体积在标准状况下一定为22.4L |
酸雨被人们称为“空中死神”可见其危害之大,下列说法中错误的是( )
| A、SO2和氮氧化物的排放是形成酸雨的原因 |
| B、酸雨是指PH<7的雨水 |
| C、在燃煤中加入生石灰可以减少污染 |
| D、酸雨可以毁坏森林和农田等 |
25℃时,在PbI2饱和溶液中,存在着平衡PbI2(s)?Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是( )
| A、溶液中Pb2+和I-浓度都增大 |
| B、溶度积常数Ksp不变 |
| C、沉淀溶解平衡不移动 |
| D、溶液中Pb2+和I-浓度不变 |
X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与Z同族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期且W不为稀有气体元素;X、Y、Z三种元素的族序数之和为16.下列说法正确的是( )
| A、Q与W不能形成10电子、14电子、18电子分子 |
| B、Y的最高价氧化物对应水化物的化学式只能表示为H4YO4 |
| C、Y、Z、Q分别与X化合,只能形成AB2型化合物 |
| D、X、Z、W中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性 |
已知稀H2SO4的浓度相等,有下列两种装置如图,下列说法正确的是( )

| A、a、b均为原电池 |
| B、c、d均为电解池 |
| C、b池中Fe极反应为Fe-2e-═Fe2+ |
| D、d池中Cu极反应为4OH--4e-═O2↑+2H2O |
