题目内容
 MnO2是碱锰电池材料中最普通的正极材料之一,在MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.(1)写出基态Mn原子的价电子排布式:
| 元素 | Mn | Fe | |
| 电离能/kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
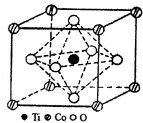
(2)在CoTiO晶胞中(结构如图所示),1个Ti原子,1个Co原子周围距离最近的O原子数目分别为
(3)单质铝、石墨和二氧化钛按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是
(4)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.已知N3-与CO2互为等电子体,则N-3的空间构型为
考点:晶胞的计算,元素电离能、电负性的含义及应用,判断简单分子或离子的构型
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)Mn原子核外有25个电子,根据构造原理书写其价电子排布式;Mn2+再失去一个电子由半满稳定状态转为不稳定状态,气态Fe2+再失去一个电子由不稳定状态转为半满稳定状态;
(2)根据晶胞结构判断,与Ti原子距离最近的O原子处于晶胞的面心上,以顶点Co原子研究,与Co原子距离最近的O原子也处于面心上,但1个Co原子为12个面共用;
(3)单质铝、石墨和二氧化钛按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,生成氧化铝与TiC;
(4)等电子体结构相似,根据二氧化碳确定N3-的空间结构及N原子杂化方式,配合物中中心原子具有空轨道,配体具有孤电子对.
(2)根据晶胞结构判断,与Ti原子距离最近的O原子处于晶胞的面心上,以顶点Co原子研究,与Co原子距离最近的O原子也处于面心上,但1个Co原子为12个面共用;
(3)单质铝、石墨和二氧化钛按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,生成氧化铝与TiC;
(4)等电子体结构相似,根据二氧化碳确定N3-的空间结构及N原子杂化方式,配合物中中心原子具有空轨道,配体具有孤电子对.
解答:
解:(1)Mn原子核外有25个电子,核外电子排布为1s22s22p63s23p63d54s2,其价电子排布式为3d54s2;Mn2+转化为Mn3+时,3d能级由稳定的3d5半满稳定状态转为不稳定状态,而气态Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转为稳定的3d5半充满状态,需要的能量相对较少,
故答案为:3d54s2;Mn2+转化为Mn3+时,3d能级由稳定的3d5半满稳定状态转为不稳定状态,而气态Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转为稳定的3d5半充满状态,需要的能量相对较少;
(2)根据晶胞结构可知,与Ti原子距离最近的O原子处于晶胞的面心上,有6个;以顶点Co原子研究,与Co原子距离最近的O原子也处于面心上,但1个Co原子为12个面共用,故1个Co原子周围与最近的O原子有12个,故答案为:6;12;
(3)单质铝、石墨和二氧化钛按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,生成氧化铝与TiC,反应方程式为:4Al+3TiO2+3C
2Al2O3+3TiC,
故答案为:4Al+3TiO2+3C
2Al2O3+3TiC;
(4)N3-与CO2互为等电子体,结构相似,N3-的空间结构为直线型,中心N原子为sp杂化方式,Co3+形成配合物[Co(N3)(NH3)5]SO4中Co3+有空轨道,为配离子,N3-、NH3有孤电子对,为配体,Co3+的配位数为6,故答案为:直线型;sp;N3-、NH3;6.
故答案为:3d54s2;Mn2+转化为Mn3+时,3d能级由稳定的3d5半满稳定状态转为不稳定状态,而气态Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转为稳定的3d5半充满状态,需要的能量相对较少;
(2)根据晶胞结构可知,与Ti原子距离最近的O原子处于晶胞的面心上,有6个;以顶点Co原子研究,与Co原子距离最近的O原子也处于面心上,但1个Co原子为12个面共用,故1个Co原子周围与最近的O原子有12个,故答案为:6;12;
(3)单质铝、石墨和二氧化钛按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,生成氧化铝与TiC,反应方程式为:4Al+3TiO2+3C
| ||
故答案为:4Al+3TiO2+3C
| ||
(4)N3-与CO2互为等电子体,结构相似,N3-的空间结构为直线型,中心N原子为sp杂化方式,Co3+形成配合物[Co(N3)(NH3)5]SO4中Co3+有空轨道,为配离子,N3-、NH3有孤电子对,为配体,Co3+的配位数为6,故答案为:直线型;sp;N3-、NH3;6.
点评:本题考查核外电子排布、晶胞结构、杂化理论与分子构型、配位键等,注意识记中学常见的晶胞结构,(1)中利用洪特特例解释为易错点,难点.

练习册系列答案
相关题目
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| B、常温下,42 g乙烯和环丙烷的混合气体中含有的碳原子数目为3NA |
| C、标准状况下,11.2 L氯仿(三氯甲烷)中含有C-Cl键的数目为1.5 NA |
| D、常温下,7.1gCl2与足量NaOH溶液作用,转移电子数目为0.2 NA |
下列离子在溶液中能大量共存,通入SO2气体后仍能大量共存的一组是( )
A、NH
| ||||
B、K+、Na-、ClO-、SO
| ||||
| C、Fe3+、Na-、Cl-、SCN- | ||||
D、K+、Al3+、NO
|
设阿伏加德罗常数为NA,下列说法中正确的是( )
| A、室温时,8 g甲烷气体所含的共价键数为2 NA |
| B、在标准状况下,11.2 L SO3所含的氧原子数为1.5 NA |
| C、32g氧气与金属钠反应生成过氧化钠时得到的电子数为4NA |
| D、1 L 2 mol/L 的MgCl2溶液中所含的Cl-数为2 NA |
 A、B、C、D、E为前四周期元素,原子序数依次增大.基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金.
A、B、C、D、E为前四周期元素,原子序数依次增大.基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金.
