题目内容
下列变化需要加入氧化剂才能实现的是( )
| A、HCl→H2 |
| B、CaCO3→CO2 |
| C、CuSO4→Cu |
| D、HCl→Cl2 |
考点:重要的氧化剂
专题:氧化还原反应专题
分析:需要加入氧化剂才能实现,则选项中为还原剂的氧化反应,还原剂中某元素的化合价升高,以此来解答.
解答:
解:A.HCl→H2中,H元素的化合价降低,需要加还原剂实现,故A不选;
B.CaCO3→CO2中,没有元素化合价的变化,不是氧化还原反应,故B不选;
C.CuSO4→Cu中,Cu元素的化合价降低,需要加还原剂实现,故C不选;
D.HCl→Cl2中,Cl元素的化合价升高,需要加氧化剂实现,故D选;
故选D.
B.CaCO3→CO2中,没有元素化合价的变化,不是氧化还原反应,故B不选;
C.CuSO4→Cu中,Cu元素的化合价降低,需要加还原剂实现,故C不选;
D.HCl→Cl2中,Cl元素的化合价升高,需要加氧化剂实现,故D选;
故选D.
点评:本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化剂、还原剂反应的考查,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
水是我们日常生活中最宝贵的资源之一.关于水的叙述正确的是( )
| A、4℃的纯水pH为7 |
| B、水的电离方程式为:H2O?2H++O2- |
| C、重水(D2O)中,质量数是质子数的两倍 |
| D、相同质量的水具有的能量:固体>液体>气体 |
下列变化能够实现的是( )
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤两种无色气体常温常压下混合后气体颜色加深
⑥有单质生成的非氧化还原反应.
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤两种无色气体常温常压下混合后气体颜色加深
⑥有单质生成的非氧化还原反应.
| A、全部 | B、只有①③⑤ |
| C、只有②④⑥ | D、只有①②③④ |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是( )
| A、电池工作时,锌是负极,发生氧化反应 |
| B、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C、电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 |
| D、电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 |
构造原理揭示的电子排布能级顺序,实质是各能级能量高低.若以E(nl)表示某能级的能量,以下各式中正确的是( )
| A、E(4s)>E(3s)>E(2s)>E(1s) |
| B、E(3d)>E(4s)>E(3p)>E(3s) |
| C、E(5s)>E(4f)>E(4s)>E(3d) |
| D、E(5s)>E(4s)>E(4f)>E(3d) |
有两种不同的碳原子,一种原子核内有6个质子和6个中子,另一种原子核内有6个质子和7个中子,则它们不相同的是( )
| A、核电荷数 | B、核外电子数 |
| C、电子层数 | D、原子的质量 |
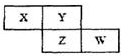 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍