题目内容
1.设NA为阿伏加德罗常数.下列说法正确的是( )| A. | 常温常压下,20 g D2O分子中所含中子数为10 NA | |
| B. | 0.1 mol FeCl3水解生成的Fe(OH)3胶粒数为0.1 NA | |
| C. | 将lmol Cl2通入水中,HC1O、Cl-、C1O-粒子数之和为2 NA | |
| D. | 常温常压下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5 NA |
分析 A、求出重水的物质的量,然后根据重水中含10个中子来分析;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、氯气和水的反应为可逆反应;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、20g重水的物质的量为1mol,而重水中含10个中子,故1mol重水中含10NA个中子,故A正确;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故水解出的氢氧化铁胶粒的个数小于0.1NA个,故B错误;
C、氯气和水的反应为可逆反应,故不能完全反应,溶液中有未反应的氯气分子,故HC1O、Cl-、C1O-粒子数之和为2 NA,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L二氧化碳的物质的量小于0.5mol,则转移的电子数小于0.5NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
12.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率 | |
| B. | 对于可逆反应来说,升高温度,正反应速率与逆反应速率均会增大 | |
| C. | 化学反应速率为0.8 mol•L-1•s-1的含义是为1s时,物质的量浓度是0.8 mol•L-1 | |
| D. | 0.1 mol•L-1盐酸和0.1 mol•L-1醋酸与形状和大小相同的大理石反应的速率相同 |
9. 钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示).下列有关说法正确的是( )
钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示).下列有关说法正确的是( )
 钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示).下列有关说法正确的是( )
钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示).下列有关说法正确的是( )| A. | O2在正极参加反应,生成OH- | |
| B. | 钢铁生锈过程中电能转化为化学能 | |
| C. | 负极的电极反应式为:Fe-3e -=Fe3+ | |
| D. | 为减缓铁制品生锈,可将其与铜相连 |
16.下列有关二氧化硫说法中正确的是( )
| A. | 二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加 | |
| B. | 二氧化硫能使品红褪色,加热后不恢复到红色 | |
| C. | 二氧化硫使酸性高锰酸钾褪色,体现了二氧化硫的漂白性 | |
| D. | 二氧化硫属于碱性氧化物,可以用NaOH溶液吸收 |
6. 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
(1)分子式为C10H9O3
(2)不能溶于水
(3)1mol该物质最多能与4molH2加成
(4)能使酸性KMnO4溶液褪色
(5)1mol该物质最多能与含2molNaOH的溶液反应.
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )(1)分子式为C10H9O3
(2)不能溶于水
(3)1mol该物质最多能与4molH2加成
(4)能使酸性KMnO4溶液褪色
(5)1mol该物质最多能与含2molNaOH的溶液反应.
| A. | (1)(2)(3)(4) | B. | (2)(4)(5) | C. | (2)(3)(4) | D. | (1)(2)(3)(4)(5) |
13.常温下,下列离子一定能大量存在于相应溶液中的是( )
| A. | 电解时阴极上无金属析出的溶液:Al3+、Zn2+、Cl-、SO42- | |
| B. | 加入铁粉有氢气生成的溶液:Mg2+、K+、NO3- | |
| C. | 通入SO2后无沉淀生成的溶液:Ba2+、Fe3+、Cl-、NO3- | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:Cl-、I-、Na+、K+ |
11.阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图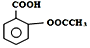 所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
 所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )| A. | 该化合物的分子式为C9H10O4 | |
| B. | 乙酰水杨酸的所有原子均在同一平面上 | |
| C. | 与乙酰水杨酸具有相同官能团,且苯环上只有两个取代基的芳香族同分异构体共有8种(不考虑立体异构) | |
| D. | 服用阿司匹林药量过大时,可出现精神错乱、惊厥甚至昏迷等水杨酸反应,可用小苏打溶液解毒 |

 消去反应
消去反应 取代反应.
取代反应.