题目内容
【题目】已知:2H2( g )+O2( g )=2H2O ( l )△H=﹣571.6kJ/mol 2H2( g )+O2( g )=2H2O ( g )△H=﹣483.6kJ/mol
CH4 ( g )+2O2( g )=2H2O ( l )+CO2( g )△H=﹣890kJ/mol
常温下,取甲烷和氢气的混合气体33.6L(标准状况下)经完全燃烧后恢复到常温,则放出的热量为730.8kJ,试求混合气体中甲烷和氢气体积比.
【答案】解:甲烷和氢气的混合气体33.6L(标准状况下),则其物质的量为1.5mol,设甲烷为xmol,氢气为ymol, 已知:2H2(g)+O2(g)=2H2O (l)△H=﹣571.6kJ/mol
2H2(g)+O2(g)=2H2O (g)△H=﹣483.6kJ/mol
CH4 (g)+2O2(g)=2H2O (l)+CO2(g)△H=﹣890kJ/mol
常温下,水为液态,则xmol甲烷燃烧放出的热量为890xkJ,ymol氢气燃烧放出热量为 ![]() ×571.6kJ,
×571.6kJ,
所以890xkJ+ ![]() ×571.6kJ=730.8kJ,
×571.6kJ=730.8kJ,
x+y=1.5mol 解得:x=0.5mol,y=1mol,
解得: ![]() =
= ![]() ,同温同压下,体积比等于物质的量之比,所以甲烷和氢气体积比为
,同温同压下,体积比等于物质的量之比,所以甲烷和氢气体积比为 ![]() ,
,
答:混合气体中甲烷和氢气体积比为 ![]()
【解析】甲烷和氢气的混合气体33.6L(标准状况下),则其物质的量为1.5mol,设甲烷为xmol,氢气为ymol,根据物质的量之比等于热量比,结合热化学方程式计算.
【考点精析】通过灵活运用反应热和焓变,掌握在化学反应中放出或吸收的热量,通常叫反应热即可以解答此题.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案【题目】以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4H2O的过程如图所示: 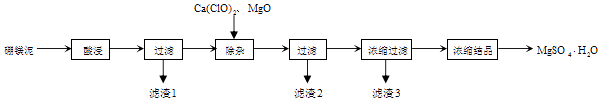
硼镁泥的主要成分如表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
资料:B2O3溶于水形成硼酸,由于硼酸易溶于水,溶解度随温度的升高而升高,而硫酸镁在80℃溶解度最大,所以常规方法很难将二者分离,目前常采用高温结晶法
回答下列问题:
(1)“滤渣1”中主要含有(写化学式)
(2)“滤渣2”中主要含有(写化学式),判断“除杂”基本完成的检验方法正确的是 .
A.取上层清液,滴加苯酚试液不显紫色
B.取上层清液,滴加KSCN,不变红
C.取上层清液,滴加K3[Fe(CN)6]不产生蓝色沉淀
(3)氧化镁的作用是 . 有同学认为用碳酸镁比用氧化镁要好,原因是 .
(4)分离滤渣3应趁热过滤的原因是 . 分离滤渣3后的母液中含有的溶质是和 , 可以采用加压、的方法得到一水合硫酸镁.