题目内容
【题目】将一定量的Cl2通入体积为40mL的氢氧化钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子,其中ClO-物质的量为0.06mol和ClO3-物质的量0.03mol,请按要求完成下列问题
(1)该反应的离子方程式为___________________________________________。
(2)该反应中,氧化剂与还原剂物质的量之比为____________________。
(3)上述反应中,通入Cl2的物质的量为________mol,氢氧化钾溶液的物质的量浓度为________mol/L。
【答案】 5Cl2 + 10OH- = 7Cl- + 2ClO- + ClO3-+5H2O 7:3 0.15 7.5
【解析】(1)根据题给信息,氯气与KOH溶液反应生成氯化钾、氯酸钾、次氯酸钾和水,根据得失电子守恒,生成的n(Cl-)=0.06×1+0.03×5=0.21mol,反应中n(Cl-):n(ClO-):n(ClO3-)=0.21:0.06:0.03=7:2:1,再根据原子守恒配平其它物质的系数,反应的离子方程式为5Cl2 + 10OH- = 7Cl- + 2ClO- + ClO3-+5H2O;(2)根据上述离子反应,氯气既做氧化剂,又做还原剂,氧化剂与还原剂物质的量之比为7:(2+1)=7:3;(3)根据氯原子守恒,由反应5Cl2 + 10OH- = 7Cl- + 2ClO- + ClO3-+5H2O可知,通入Cl2的物质的量为![]() ;加入的KOH的物质的量为
;加入的KOH的物质的量为![]() ,物质的量浓度为
,物质的量浓度为![]() 。
。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有很大的价值.
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离.
①写出硫酸溶液与Fe2O3反应的离子方程式 .
②初步分离得到的滤渣主要成分是 .
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+ , 结合表分析其原因 .
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验.
①氨水使滤液中铝离子沉淀的离子方程式为 .
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是 , 选择该范围的理由是 . 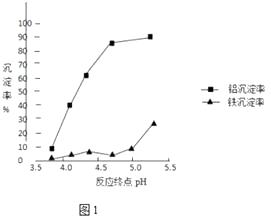
(4)Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3 .
已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
依据资料可知,将硫酸铝铵与其他溶质分离的方法是 .
(5)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整.



