题目内容
14.0.1mol某烃在足量的氧气中完全燃烧,生成的CO2和水各0.6mol.若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则该烃的结构简式为 .
.
分析 根据C元素、H元素守恒确定该烃的分子式;不饱和对为1,若该烃不能使溴水或高锰酸钾溶液褪色,说明烃中苯环不饱和键,该烃为环烷烃,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则该烃为环己烷.
解答 解:n(烃):n(C):n(H)=n(烃):n(CO2):2n(H2O)=0.1mol:0.6mol:0.6mol×2=1:6:12,即1个分子中含有6个C原子、12个H原子,故该烃的分子式为:C6H12,
该烃的分子式为C6H12,其不饱和对为1,若该烃不能使溴水或高锰酸钾溶液褪色,说明烃中苯环不饱和键,故该烃为环烷烃,其一溴取代物只有一种,说明分子中只有一种H原子,该烃为环己烷,结构简式为: ,
,
故答案为: .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握守恒思想在确定有机物分子式中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
4.氧杂环丙烷的结构如图所示,下列说法正确的是( )
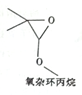

| A. | 该有机物能与金属钠反应 | |
| B. | 该有机物的分子式为C5H9O2 | |
| C. | 该有机物的同分异构体(不考虑立体异构)中,属于羧酸的物质共有5种 | |
| D. | 该有机物的同分异构体(不考虑立体异构体)中,能水解生成羧酸与醇的物质共有9种 |
5.现有部分短周期元素的性质或原子结构如表:
(1)元素X位于元素周期表的第二周期第IVA族,
(2)元素Y的原子结构示意图为 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取少量试样加入到试管中,加入氢氧化钠溶液,加热,在试管口用湿润的红色石蕊试纸检验放出气体,试纸由红变蓝.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取少量试样加入到试管中,加入氢氧化钠溶液,加热,在试管口用湿润的红色石蕊试纸检验放出气体,试纸由红变蓝.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应.
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y的原子结构示意图为
 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取少量试样加入到试管中,加入氢氧化钠溶液,加热,在试管口用湿润的红色石蕊试纸检验放出气体,试纸由红变蓝.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取少量试样加入到试管中,加入氢氧化钠溶液,加热,在试管口用湿润的红色石蕊试纸检验放出气体,试纸由红变蓝.(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应.
9.酯类物质广泛存在于草莓、香蕉、梨等水果中,某同学从成熟的香蕉中分离出一种酯,然后将该酯在酸性条件下进行水解实验,得到分子式为C2H4O2和C4H10O的两种物质.下列有关的分析判断正确的是( )
| A. | C4H10O的同分异构体有很多种,其中属于醇类只有5种 | |
| B. | 水解得到的两种物质,C2H4O2可以与金属钠作用放出氢气,而C4H10O不可以 | |
| C. | 该同学分离出的酯的化学式可表示为C6H12O2 | |
| D. | 水解得到的物质C2H4O2和甲醛的最简式相同,所以二者的化学性质相似 |
19.绿色化学对化学反应提出“原子经济性”的概念和要求.理想的原子经济性反应是原料分子中的原子全部转变为所需产物,不产生副产物.下列反应符合原子经济性的是( )
| A. | 乙烷与氯气反应制备氯乙烷 | |
| B. | 乙烯与氧气在银催化作用下制备环氧乙烷 | |
| C. | 乙醇与浓硫酸共热制备乙烯 | |
| D. | 乙酸与乙醇在浓硫酸作用下制备乙酸乙酯 |
6.有机物 的正确命名为( )
的正确命名为( )
 的正确命名为( )
的正确命名为( )| A. | 2-乙基-3,3-二甲基-4-乙基戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 3,3,4-三甲基已烷 | D. | 3,4,4-三甲基已烷 |
3.如图所示的实验操作,不能达到相应目的是( )
| A. |  干燥NH3 | B. |  检验K2CO3中的K+ | ||
| C. |  证明氨气极易溶于水 | D. |  实验室制氨气 |
4.下列反应中通入的气体只做氧化剂的是( )
| A. | SO2通入H2S溶液中 | B. | Cl2通入NaOH溶液 | ||
| C. | SO2通入KOH溶液中 | D. | H2S通入溴水中 |