题目内容
 CO和H2作为燃料和化工原料,有着十分广泛的应用.
CO和H2作为燃料和化工原料,有着十分广泛的应用.(1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ?mol-1则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的△H=
标准状况下将33.6LCO、H2的混合气体在足量氧气充分燃烧,生成CO2和H2O,将生成的产物通过足量的过氧化钠固体,固体增加的质量为16g,则原混合气体中CO、H2的体积比为
(2)利用反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图1所示.
则①M应是电源的
②该电解反应的离子方程式为
(3)一定温度下在体积为5L的密闭容器中加入2mol Fe(s)与1molH2O(g),t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol.
①t1~t2这段时间内的化学反应速率V(H2)=
②若继续通人1mol H2O(g)再次达到平衡后,H2的物质的量为
③该反应的逆反应速率随时间变化的关系如图2,t1时改变了某种条件,改变的条件可能是
考点:用盖斯定律进行有关反应热的计算,化学反应速率与化学平衡图象的综合应用,电解原理
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)据已知反应利用盖斯定律书写热化学方程式;2CO2+2Na2O2=2Na2CO3+O2,固体增加的质量相当于CO的质量,2H2+O2=2H2O,2H2O+2Na2O2=4NaOH+O2↑,
二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量,以此计算;
(2)用惰性电极电解饱和食盐水阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气;溶液中水的电离被促进生成氢氧化钠;电解NaCl结束后,再电解水2H2O
2H2↑+O2↑;
(3)①t1~t2这段时间内氢气的浓度变化计算出氢气的反应速率;
②反应前后气体体积不变,增大水蒸气的量平衡不移动,水蒸气的物质的量增大一倍,生成物增多一倍;
③根据t1时逆反应速率变化判断改变的条件.
二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量,以此计算;
(2)用惰性电极电解饱和食盐水阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气;溶液中水的电离被促进生成氢氧化钠;电解NaCl结束后,再电解水2H2O
| ||
(3)①t1~t2这段时间内氢气的浓度变化计算出氢气的反应速率;
②反应前后气体体积不变,增大水蒸气的量平衡不移动,水蒸气的物质的量增大一倍,生成物增多一倍;
③根据t1时逆反应速率变化判断改变的条件.
解答:
解:(1)已知①C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1②C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ?mol-1,据盖斯定律,①-②得:CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=-524.8kJ?mol-1;
2CO2+2Na2O2=2Na2CO3+O2,固体增加的质量相当于CO的质量,2H2+O2=2H2O,2H2O+2Na2O2=4NaOH+O2↑,
二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量,所以有一氧化碳和氢气16g,标准状况下33.6LCO、H2的混合气体物质的量为1.5mol,
设混合气体中含有xmolCO,ymolH2,
则 28x+2y=16
x+y=1.5
解得x=0.5,y=1,相同条件下,其物质的量之比等于体积比,所以混合气体中CO、H2的体积比为1:2,
故答案为:-524.8,1:2;
(2)①用惰性电极电解饱和食盐水,阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气;溶液中水的电离被促进生成氢氧化钠;电解NaCl结束后,再电解水2H2O
2H2↑+O2↑,根据图示1反应装置及现象可知M极连接的试管生成的气体多,应是电源的负极,故答案为:负极;
②用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中还生成氢氧化钠,所以电池反应式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,离子方程式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(3)铁与水蒸气反应的方程式为:3Fe+4H2O(g)
Fe3O4+4H2 ,
①t1~t2这段时间内氢气的浓度变化为:0.35mol-0.20mol=0.15mol,这段时间内的化学反应速率v(H2)=
=
mol?L-1?s-1,
故答案为:
mol?L-1?s-1;
②反应前后气体体积不变,增大水蒸气的量平衡不移动,水蒸气的物质的量增大一倍,生成物增多一倍,生成的氢气为0.40mol,
故答案为:0.40;
③t1时反应未达到平衡,改变条件后逆反应速率突然增大,且继续增大,可知为加入催化剂或升高温度或增大气体反应物浓度,
故答案为:加入催化剂或升高温度(或增大气体反应物浓度).
2CO2+2Na2O2=2Na2CO3+O2,固体增加的质量相当于CO的质量,2H2+O2=2H2O,2H2O+2Na2O2=4NaOH+O2↑,
二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量,所以有一氧化碳和氢气16g,标准状况下33.6LCO、H2的混合气体物质的量为1.5mol,
设混合气体中含有xmolCO,ymolH2,
则 28x+2y=16
x+y=1.5
解得x=0.5,y=1,相同条件下,其物质的量之比等于体积比,所以混合气体中CO、H2的体积比为1:2,
故答案为:-524.8,1:2;
(2)①用惰性电极电解饱和食盐水,阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气;溶液中水的电离被促进生成氢氧化钠;电解NaCl结束后,再电解水2H2O
| ||
②用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中还生成氢氧化钠,所以电池反应式为2NaCl+2H2O
| ||
| ||
| ||
(3)铁与水蒸气反应的方程式为:3Fe+4H2O(g)
| ||
①t1~t2这段时间内氢气的浓度变化为:0.35mol-0.20mol=0.15mol,这段时间内的化学反应速率v(H2)=
| ||
| t2-t1 |
| 0.03 |
| t2-t1 |
故答案为:
| 0.03 |
| t2-t1 |
②反应前后气体体积不变,增大水蒸气的量平衡不移动,水蒸气的物质的量增大一倍,生成物增多一倍,生成的氢气为0.40mol,
故答案为:0.40;
③t1时反应未达到平衡,改变条件后逆反应速率突然增大,且继续增大,可知为加入催化剂或升高温度或增大气体反应物浓度,
故答案为:加入催化剂或升高温度(或增大气体反应物浓度).
点评:本题考查了盖斯定律、化学计算、原电池电解池、化学反应速率的计算、化学反应速率的影响因素,综合性强,题目难度较大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
能正确表示下列化学反应的离子方程式的是( )
| A、氢氧化钡溶液与硫酸的反应 OH-+H+=H2O |
| B、金属镁与稀盐酸反应 Mg+2H++2 Cl-=MgCl2+H2↑ |
| C、金属钠投入到冷水中 Na+H2O=Na++OH-+H2↑ |
| D、氯气通入氢氧化钠溶液中 Cl2+2OH-=Cl-+ClO-+H2O |
下列有关物质的分类全部正确的一组是( )
| 单质 | 混合物 | 氧化物 | 电解质 | |
| A | Cu | 冰水混合物 | CuO | CO2 |
| B | SO3 | Na2CO3 | 双氧水 | KOH |
| C | CH3CH2OH | 空气 | KClO3 | Mg |
| D | N2 | 浓硫酸 | H2O | FeCl3 |
| A、A | B、B | C、C | D、D |
常温下,下列各组离子可能大量共存的是( )
| A、能使甲基橙显黄色的溶液:Cl-、CO32-、K+、AlO2- |
| B、含CO32-的溶液:Ca2+、Na+、Cl-、NO3- |
| C、加入Al能放出H2的溶液中:Cl-、SO42-、NH4+、NO3-、Mg2+ |
| D、在由水电离出的c(OH-)=10-13mol?L-1的溶液中:[Ag(NH3)2]+、Na+、Fe2+、AlO2-、I- |
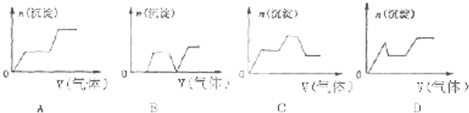
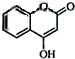 是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成: