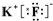题目内容
10.在实验室里可以用浓盐酸跟二氧化锰起反应制取氯气,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.分析 MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯化锰、氯气和水,Mn元素化合价由+4价降低到+2价,Cl元素化合价由-1价升高到0价,根据原子守恒、得失电子守恒配平.
解答 解:二氧化锰与浓盐酸在加热条件下反应,Mn元素化合价由+4价降低到+2价,转移电子数为2,Cl元素化合价由-1价升高为0价,所以最小公倍数为2,根据原子守恒、得失电子守恒,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
点评 本题考查了氯气的实验室制法反应原理,解题关键在于分析化合价变化丙根据原子守恒、得失电子守恒配平,题目难度不大.

练习册系列答案
相关题目
1.下列推断正确的是( )
| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: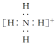 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CO2的分子模型示意图: | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3σ键 |
18.95℃时某溶液的pH=6,对该溶液的判断正确的是( )
| A. | 呈酸性 | B. | c(H+)=1×10-6mol/L | ||
| C. | c(OH-)=1×10-6mol/L | D. | 无法判断 |
5.下列有关化学用语使用正确的是( )
| A. | 硫离子的结构示意 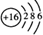 | B. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | ||
| C. | 明矾的化学式:KAlSO4•12H2O | D. | CO2的电子式: |
15.下列各组元素中,属于同一主族的是( )
| A. | F、Cl、Br | B. | Na、Mg、Al | C. | Si、P、S | D. | O、S、Cl |
2.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )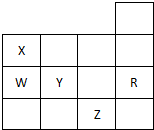

| A. | 常温时五种元素的单质中,Z单质的沸点最高 | |
| B. | Y元素的非金属性比W元素的非金属性强 | |
| C. | Y、Z的阴离子的电子层结构都与R原子的相同 | |
| D. | Y的氢化物的沸点比H2O的沸点高 |
19.下列关于物质的分类、性质、用途说法全部正确的是( )
| A. | 水玻璃-混合物氨水-弱碱 | |
| B. | 油脂-天然高分子化合物 有机玻璃-合成高分子化合物 | |
| C. | 二氧化硅-半导体材料硅单质-光纤材料 | |
| D. | 高锰酸钾溶液-氧化性碳酸钠溶液-碱性 |
20. 实验室制备1,2一二溴乙烷的反应原理如下:
实验室制备1,2一二溴乙烷的反应原理如下:
CH3CH2OH$\frac{{H}_{2}S{O}_{4}(浓)}{170℃}$CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:
有关数据列表如下:
请按要求回答下列问题:
回答下列问题:
(1)装置A中仪器a和b的名称分别为恒压分液漏斗、三颈烧瓶;
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)判断该制备反应已经结束的最简单方法是观察D中颜色是否完全褪去;
(4)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.亚硫酸氢钠 c.碘化钠溶液 d.乙醇
(5)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2一二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
 实验室制备1,2一二溴乙烷的反应原理如下:
实验室制备1,2一二溴乙烷的反应原理如下:CH3CH2OH$\frac{{H}_{2}S{O}_{4}(浓)}{170℃}$CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1.2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A中仪器a和b的名称分别为恒压分液漏斗、三颈烧瓶;
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)判断该制备反应已经结束的最简单方法是观察D中颜色是否完全褪去;
(4)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.亚硫酸氢钠 c.碘化钠溶液 d.乙醇
(5)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2一二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
 ,写出A、B形成化合物的电子式
,写出A、B形成化合物的电子式