题目内容
14.为了测定某铜银合金的组成,将30.0g合金溶于80mL13.5mol•L-1的浓HNO3中待合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的H+浓度为1mol/L,假设反应后溶液的体积仍为80mL,试计算:(1)被还原的硝酸的物质的量;
(2)合金中银的质量.
分析 金属与硝酸反应生成硝酸盐和氮的氧化物,被还原的硝酸的物质的量等于生成气体的物质的量,根据反应中消耗硝酸的物质的量结合质量守恒列方程组可计算合金中银的质量分数,以此来解答.
解答 解:(1)被还原的硝酸的物质的量等于生成气体的物质的量,即:n(HNO3)(被还原)=$\frac{6.72L}{22.4L/mol}$=0.3mol,
答:被还原的硝酸的物质的量为0.3mol.
(2)剩余硝酸的物质的量为n(HNO3)(剩余)=0.08L×1mol/L=0.08mol,
参加反应的硝酸为:0.08L×13.5mol/L-0.08mol=1mol,
设混合物中含有xmolAg,ymolCu,
则有$\left\{\begin{array}{l}{106x+64y=30.0(质量守恒)}\\{x+2y+0.3+0.08=1.08(N元素守恒)}\end{array}\right.$
解之得:x=0.1,y=0.3
则:m(Ag)=0.1mol×108g/mol=10.8g,
合金中银的质量分数为$\frac{10.8g}{30.0g}$=36.0%.
答:合金中银的质量分数为36.0%.
点评 本题考查氧化还原反应的计算,为高频考点,把握原子守恒、质量守恒的为解答的关键,侧重分析与计算能力的考查,注意守恒法可避免书写化学方程式的繁琐,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.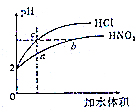 室温下,体积和pH都相同的盐酸和HNO2溶液加水稀释时的pH变化曲线如图所示,下列有关说法正确的是( )
室温下,体积和pH都相同的盐酸和HNO2溶液加水稀释时的pH变化曲线如图所示,下列有关说法正确的是( )
 室温下,体积和pH都相同的盐酸和HNO2溶液加水稀释时的pH变化曲线如图所示,下列有关说法正确的是( )
室温下,体积和pH都相同的盐酸和HNO2溶液加水稀释时的pH变化曲线如图所示,下列有关说法正确的是( )| A. | 原HNO2溶液的浓度为0.01mol•L-1 | |
| B. | 溶液中水的电离程度:b>c | |
| C. | $\frac{c(N{{O}_{2}}^{-})}{c(HN{O}_{2})•c(O{H}^{-})}$比值:b>a | |
| D. | 等浓度的HNO2与NaOH溶液按体积比为2:1充分反应的混合液中,c(NO2-)+2c(OH-)=c(HNO2)+2c(H+) |
5.下列实验中,颜色的变化与氧化还原反应有关的是( )
| A. | 往紫色石蕊试液中加入盐酸,溶液变红 | |
| B. | 饱和FeCl3溶液在沸水中变成红褐色胶体 | |
| C. | 向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 | |
| D. | SO2使滴有酚酞的NaOH溶液褪色 |
19.为了提纯下表中的物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH(CH3COOH) | CaO | 蒸馏 |
| D | CO2(SO2) | Na2CO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
7. 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
(1)下列措施中既有利于增大反应速率又有利于提高CO转化率的是D.
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
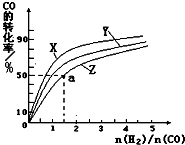
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线Z对应的温度是270℃
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数 K=4L2•mol-2.
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是增大H2的浓度;且该条件所改变的量是增大了0.1mol•L-1.
 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1(1)下列措施中既有利于增大反应速率又有利于提高CO转化率的是D.
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线Z对应的温度是270℃
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数 K=4L2•mol-2.
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
4.某种有机物结构简式如图所示.有关该物质的说法正确的是( )
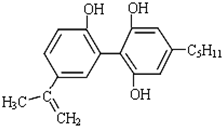

| A. | 一定条件下1mol该物质能与1molH2发生加成反应 | |
| B. | 该有机物能与FeCl3溶液发生显色反应 | |
| C. | 该有机物能与碳酸氢钠溶液反应 | |
| D. | 该有机物是苯酚的同系物 |
5.常温下,下列各组高于一定能在制定溶液中大量共存的是( )
| A. | pH=14的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 中性溶液中:Fe2+、K+、Cl-、${SO}_{4}^{2-}$ | |
| C. | 含有大量Ba2+的溶液中:Mg2+、Na+、${NO}_{3}^{-}$、Cl- | |
| D. | 由水电离出的c(H+)=1×10-12mol-1的溶液中:Na+、Mg2+、HCO3-、CH3COO- |