题目内容
用NA表示阿伏加德罗常数,则下列说法正确的是( )
| A、1mol/L Na2SO4溶液中有2NA个Na+ |
| B、18gD2O含有的电子数为10NA |
| C、0.3molO2与4.48LO3所含的氧原子数一定相等 |
| D、标准状况下11.2 L氮气和氧气的混合气体所含原子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、硫酸钠溶液的体积不知,无法计算硫酸钠中钠离子的数目;
B、重水中含有10个电子,18g重水的物质的量为0.9mol;
C、没有告诉是标准状况下,不能使用标况下的气体摩尔体积计算臭氧的物质的量;
D、氮气和氧气都是双原子分子,根据标况下的气体摩尔体积计算出11.2L氮气和氧气的物质的量.
B、重水中含有10个电子,18g重水的物质的量为0.9mol;
C、没有告诉是标准状况下,不能使用标况下的气体摩尔体积计算臭氧的物质的量;
D、氮气和氧气都是双原子分子,根据标况下的气体摩尔体积计算出11.2L氮气和氧气的物质的量.
解答:
解:A、没有告诉1mol/L Na2SO4溶液的体积,无法计算硫酸钠的物质的量及钠离子的数目,故A错误;
B、18g重水的物质的量为0.9mol,0.9mol重水中含有9mol电子,含有的电子数为9NA,故B错误;
C、没有告诉是标况下,题中条件无法计算臭氧的物质的量,故C错误;
D、标况下11.2L氮气和氧气的物质的量为0.5mol,0.5mol混合气体中含有1mol原子,所含原子数为NA,故D正确;
故选D.
B、18g重水的物质的量为0.9mol,0.9mol重水中含有9mol电子,含有的电子数为9NA,故B错误;
C、没有告诉是标况下,题中条件无法计算臭氧的物质的量,故C错误;
D、标况下11.2L氮气和氧气的物质的量为0.5mol,0.5mol混合气体中含有1mol原子,所含原子数为NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件;注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,也要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、11.2L氧气与臭氧的混合气体中含NA个氧原子 |
| B、31g白磷(分子式为P4)中含有P-P共价键数目为1.5NA |
| C、标准状况下,22.4LSO2的中心原子所含有的孤电子对数为2NA |
| D、1 molNa2O2跟H2O反应转移电子的数目为2NA |
已知H2(g)+Cl2(g)═2HCl(g);△H=-184.6kJ?mol-1,则反应2HCl(g)═H2(g)+Cl2(g)的△H为( )
| A、+92.3 kJ?mol-1 |
| B、-92.3 kJ?mol-1 |
| C、-369.2 kJ?mol-1 |
| D、+184.6 kJ?mol-1 |
设NA为阿伏加德罗常数,则下列叙述正确的是( )
| A、标准状况下,2.24 L苯中含有0.3NA个碳碳双键 |
| B、22.4LCl2通入水中充分反应,共转移NA个电子 |
| C、1 L 1 mol/L的氯化铜溶液中Cu2+的数目小于NA |
| D、5.6g铁在0.1 mol氯气中充分燃烧,转移的电子数为0.3NA |
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+
Fe2++Cr3+.下列说法一定正确的是( )
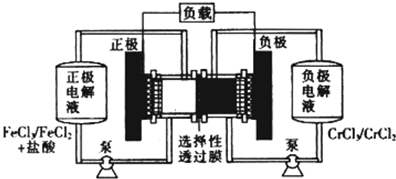
| 放电 |
| 充电 |

| A、充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B、电池放电肘,负极的电极反应式为Fe2+-e-=Fe3+ |
| C、电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
| D、放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1mol.L-1 |
化学用语是学习化学的重要工具.以下化学用语或表述正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、碳正离 中质子数与电子数之比值为3:2 中质子数与电子数之比值为3:2 |
| C、钙离子的基态电子排布比:1s22s22p63s23p6 |
| D、NaHCO3水解反应的离子方程式:HCO3-+H2O?H3O++CO32- |

 化合物A、D、F是中学化学中常见的物质,化合物 B、C、E中含有两种相同的元素.这些化合物之间存在下面的关系.其中A和B的反应是一种重要化工生产中的主要反应之一.
化合物A、D、F是中学化学中常见的物质,化合物 B、C、E中含有两种相同的元素.这些化合物之间存在下面的关系.其中A和B的反应是一种重要化工生产中的主要反应之一.