题目内容
17.下列说法正确的是( )| A. | 溶液中水的离子积常数(KW)随溶液浓度的改变而改变 | |
| B. | 一般情况下,一元弱酸HA的Ka越大,表明该酸的酸性越弱 | |
| C. | 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
分析 A.水的离子积与温度有关,与溶液浓度大小无关;
B.电离平衡常数越大,则该弱酸的酸性越强;
C.平衡常数与温度有关,不受压强的影响;
D.溶度积与难溶物自身性质、温度大小有关,与溶液浓度大小无关.
解答 解:A.溶液中水的离子键只受温度影响,不随溶液浓度的变化发生变化,故A错误;
B.一般情况下,一元弱酸HA的Ka越大,表明该酸越容易电离,则其酸性越强,故B错误;
C.对已达到化学平衡的反应,改变压强,平衡常数(K)一定不会改变,故C错误;
D.难溶物溶度积Ksp与溶液中的离子浓度无关,只与难溶电解质的性质和温度有关,故D正确;
故选D.
点评 本题考查较为综合,涉及电离平衡常数、水的离子积常数、难溶物溶度积、化学平衡的影响等知识,题目难度中等,明确平衡常数与温度有关,与溶液浓度大小无关为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
7.化学与日常生活密切相关,下列说法错误的是( )
| A. | Si可用于制造半导体材料 | |
| B. | 二氧化硫可广泛用于食品的增白 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 84消毒液的有效成分是NaClO,可用于环境的消毒杀菌 |
8.短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小,Y原子在周期表中处于族序数等于周期序数3倍的位置,Z是最外层电子数最少的金属元素,W与Y属于同一主族.下列叙述正确的是( )
| A. | 原子半径:W>Z>Y | |
| B. | 元素W最高价氧化物的水化物为强酸 | |
| C. | 化合物X2Y、Z2Y中化学键的类型相同 | |
| D. | 元素Y的简单气态氢化物的热稳定性比W的弱 |
5.当光束通过下列分散系时,能产生丁达尔效应的是( )
| A. | CuSO4溶液 | B. | Na2CO3溶液 | C. | Fe(OH)3胶体 | D. | Ba(OH)2溶液 |
12.下列离子方程式书写正确的是( )
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++CO32- | |
| B. | 过量的CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O═HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
2.下列事实不能用平衡移动原理解释的是( )
| A. | Mg(OH)2不溶于水,但能溶于浓NH4Cl溶液中 | |
| B. | 水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸除去 | |
| C. | 洗涤BaSO4沉淀时,用稀硫酸洗涤BaSO4沉淀比用蒸馏水洗涤损失少 | |
| D. | FeCl3溶液中混有FeCl2,常加入少量的H2O2,使Fe2+氧化为Fe3+ |
9.钠在一定条件下可以在CO2中燃烧生成Na2O和C,下列说法不正确的是( )
| A. | 该条件下,钠的还原性强于C | |
| B. | 若CO2过量,则有Na2CO3生成 | |
| C. | 该反应中化学能除转化为热能外,还转化为电能 | |
| D. | Na2O是离子化合物,其中离子半径:r(Na+)>r(O2-) |
6.下列化学反应的离子方程式正确的是( )
| A. | 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O═2HCO3-+H2SiO3↓ | |
| B. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NH4HCO3溶液中加入足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
15.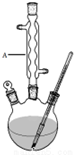 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(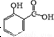 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g.
常用物理常数:
请根据以上信息回答下列问题:
(1)仪器A的名称是球形冷凝管,加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是停止加热,待冷却后加入.
(2)制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(3)实验中加入甲苯对合成水杨酸甲酯的作用是加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率.
(4)反应结束后,分离出甲醇采用的方法是蒸馏(或水洗分液).
(5)实验中加入无水硫酸镁的作用是除水或干燥.本实验的产率为60%(保留两位有效数字).
 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g.
常用物理常数:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是球形冷凝管,加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是停止加热,待冷却后加入.
(2)制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(3)实验中加入甲苯对合成水杨酸甲酯的作用是加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率.
(4)反应结束后,分离出甲醇采用的方法是蒸馏(或水洗分液).
(5)实验中加入无水硫酸镁的作用是除水或干燥.本实验的产率为60%(保留两位有效数字).