题目内容
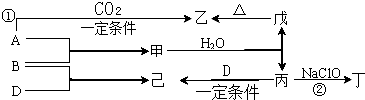
二草酸合铜(Ⅱ)酸钾{K2[Cu(C2O4)2]?2H2O}制备流程如图1:
(已知H2C2O4
CO↑+CO2↑+H2O)
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤.①用双层滤纸的可能原因是 .
②用蒸馏水洗涤氧化铜时,如何证明已洗涤干净: .
(2)本实验用K2CO3粉末与草酸溶液制取KHC2O4溶液而不用KOH粉末代替K2CO3粉末的可能原因是 .
(3)为了提高CuO的利用率,如何让CuO充分转移到热的KHC2O4溶液中: ;50℃水浴加热至反应充分,发生反应的化学方程式为 ;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得二草酸合铜(Ⅱ)酸钾晶体.
(4)若实验室只有含少量FeSO4?7H2O的硫酸铜晶体,欲制备较纯净的CuSO4溶液.
Ⅰ.相关数据(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算):
Ⅱ.提供的试剂有:a.蒸馏水 b.稀硫酸 c.H2O2溶液 d.纯净的Cu(OH)2粉末 e.氨水
需经过的步骤有:① 、② 、③ 、④过滤得CuSO4溶液.
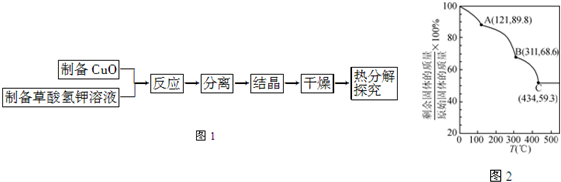
(5)将制得的K2[Cu(C2O4)2]?2H2O进行热重分析,结果如图2,由图2知在C点剩余固体为K2CO3和 .

(已知H2C2O4
| ||
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤.①用双层滤纸的可能原因是
②用蒸馏水洗涤氧化铜时,如何证明已洗涤干净:
(2)本实验用K2CO3粉末与草酸溶液制取KHC2O4溶液而不用KOH粉末代替K2CO3粉末的可能原因是
(3)为了提高CuO的利用率,如何让CuO充分转移到热的KHC2O4溶液中:
(4)若实验室只有含少量FeSO4?7H2O的硫酸铜晶体,欲制备较纯净的CuSO4溶液.
Ⅰ.相关数据(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算):
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 5.8 | 8.8 |
需经过的步骤有:①
(5)将制得的K2[Cu(C2O4)2]?2H2O进行热重分析,结果如图2,由图2知在C点剩余固体为K2CO3和
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)①从过滤时滤纸易破损以及过滤的目的来分析;
②可以检验是否存在硫酸根离子来检验是否洗涤干净;
(2)草酸易分解,氢氧化钾溶解放热,与草酸反应也放热,会导致溶液温度过高,草酸分解;
(3)过滤时滤纸上沾有大量的氧化铜固体,所以应直接将洗涤干净的氧化铜固体连同滤纸一起加入到草酸氢钾溶液中,充分反应后取出滤纸;
(4)实验需除去晶体中的杂质FeSO4?7H2O晶体,亚铁离子一般要先氧化成铁离子,再条件PH值转化成氢氧化铁沉淀而除去,对于固体一般要先配成溶液,所以步骤①为将含少量FeSO4?7H2O的硫酸铜晶体溶于稀硫酸酸化的蒸馏水中②加入足量的H2O2溶液③用纯净的Cu(OH)2粉末调节溶液pH约为4(或3.2~4.7之间);
(5)分解后的固体为钾的化合物和铜的化合物,且钾与铜原子个数比为2:1,设K2[Cu(C2O4)2]?2H2O参与反应,该点生成1mol K2CO3,则铜的化合物质量为354×0.593-138=72,铜元素含量为1mol,质量64g,剩余8g,只能为氧元素且物质的量为0.5mol,故为Cu2O.
②可以检验是否存在硫酸根离子来检验是否洗涤干净;
(2)草酸易分解,氢氧化钾溶解放热,与草酸反应也放热,会导致溶液温度过高,草酸分解;
(3)过滤时滤纸上沾有大量的氧化铜固体,所以应直接将洗涤干净的氧化铜固体连同滤纸一起加入到草酸氢钾溶液中,充分反应后取出滤纸;
(4)实验需除去晶体中的杂质FeSO4?7H2O晶体,亚铁离子一般要先氧化成铁离子,再条件PH值转化成氢氧化铁沉淀而除去,对于固体一般要先配成溶液,所以步骤①为将含少量FeSO4?7H2O的硫酸铜晶体溶于稀硫酸酸化的蒸馏水中②加入足量的H2O2溶液③用纯净的Cu(OH)2粉末调节溶液pH约为4(或3.2~4.7之间);
(5)分解后的固体为钾的化合物和铜的化合物,且钾与铜原子个数比为2:1,设K2[Cu(C2O4)2]?2H2O参与反应,该点生成1mol K2CO3,则铜的化合物质量为354×0.593-138=72,铜元素含量为1mol,质量64g,剩余8g,只能为氧元素且物质的量为0.5mol,故为Cu2O.
解答:
解:(1)①从过滤的目的为了除尽不溶的固体,用双层滤纸的可能原因是防止CuO颗粒穿过滤纸;从过滤时滤纸易破损,用双层滤纸的可能原因是防止滤纸破损,故答案为:防止CuO颗粒穿过滤纸或者防止滤纸破损;
②可以检验是否存在硫酸根离子来检验是否洗涤干净,具体方法是:取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀说明已洗涤干净,故答案为:取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀说明已洗涤干净;
(2)因为草酸易分解,又氢氧化钾为强碱溶解放热,与草酸反应也放热,会导致溶液温度过高使草酸分解,所以不用KOH粉末代替K2CO3粉末,故答案为:H2C2O4与KOH发生显著的放热反应,导致草酸大量分解;
(3)过滤时滤纸上沾有大量的氧化铜固体,所以应直接将洗涤干净的氧化铜固体连同滤纸一起加入到草酸氢钾溶液中,充分反应后取出滤纸;根据题意,反应的方程式为:2KHC2O4+CuO
K2[Cu(C2O4)2]+H2O,
故答案为:直接将洗涤干净的CuO固体连同滤纸一起投入到KHC2O4溶液中;2KHC2O4+CuO
K2[Cu(C2O4)2]+H2O;
(4)实验需除去晶体中的杂质FeSO4?7H2O晶体,亚铁离子一般要先氧化成铁离子,再条件PH值转化成氢氧化铁沉淀而除去,对于固体一般要先配成溶液,所以步骤①为将含少量FeSO4?7H2O的硫酸铜晶体溶于稀硫酸酸化的蒸馏水中②加入足量的H2O2溶液③用纯净的Cu(OH)2粉末调节溶液pH约为4(或3.2~4.7之间),
故答案为:①将含有杂质的硫酸铜晶体溶于稀硫酸酸化的蒸馏水中;②加入足量的H2O2溶液;③用纯净的Cu(OH)2粉末调节溶液pH约为4(或3.2~4.7之间);
(5)分解后的固体为钾的化合物和铜的化合物,且钾与铜原子个数比为2:1,设K2[Cu(C2O4)2]?2H2O参与反应,C点生成1mol K2CO3,则铜的化合物质量为354×0.593-138=72,铜元素含量为1mol,质量64g,剩余8g,只能为氧元素且物质的量为0.5mol,故为Cu2O,故答案为:Cu2O.
②可以检验是否存在硫酸根离子来检验是否洗涤干净,具体方法是:取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀说明已洗涤干净,故答案为:取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀说明已洗涤干净;
(2)因为草酸易分解,又氢氧化钾为强碱溶解放热,与草酸反应也放热,会导致溶液温度过高使草酸分解,所以不用KOH粉末代替K2CO3粉末,故答案为:H2C2O4与KOH发生显著的放热反应,导致草酸大量分解;
(3)过滤时滤纸上沾有大量的氧化铜固体,所以应直接将洗涤干净的氧化铜固体连同滤纸一起加入到草酸氢钾溶液中,充分反应后取出滤纸;根据题意,反应的方程式为:2KHC2O4+CuO
| ||
故答案为:直接将洗涤干净的CuO固体连同滤纸一起投入到KHC2O4溶液中;2KHC2O4+CuO
| ||
(4)实验需除去晶体中的杂质FeSO4?7H2O晶体,亚铁离子一般要先氧化成铁离子,再条件PH值转化成氢氧化铁沉淀而除去,对于固体一般要先配成溶液,所以步骤①为将含少量FeSO4?7H2O的硫酸铜晶体溶于稀硫酸酸化的蒸馏水中②加入足量的H2O2溶液③用纯净的Cu(OH)2粉末调节溶液pH约为4(或3.2~4.7之间),
故答案为:①将含有杂质的硫酸铜晶体溶于稀硫酸酸化的蒸馏水中;②加入足量的H2O2溶液;③用纯净的Cu(OH)2粉末调节溶液pH约为4(或3.2~4.7之间);
(5)分解后的固体为钾的化合物和铜的化合物,且钾与铜原子个数比为2:1,设K2[Cu(C2O4)2]?2H2O参与反应,C点生成1mol K2CO3,则铜的化合物质量为354×0.593-138=72,铜元素含量为1mol,质量64g,剩余8g,只能为氧元素且物质的量为0.5mol,故为Cu2O,故答案为:Cu2O.
点评:本题主要考查工业流程中的实验综合应用问题,掌握实验基本操作和物质性质是解题关键,题目难度较大.

练习册系列答案
相关题目
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、等质量的H2和Cl2所含的分子数一样多 |
| B、2mol?L-1的MgCl2溶液中含Mg2+数为2NA |
| C、常温常压下,11.2LCO2所含分子数为0.5NA |
| D、室温下,8g甲烷(CH4)中所含氢原子数为2NA |
下列有关物质分类或归类正确的一组是( )
①液氨、液氯、干冰、碘化银均为化合物
②漂白粉、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、醋酸、次氯酸均为电解质
④Na2O2、Na2CO3、Na2SiO3均为钠盐.
①液氨、液氯、干冰、碘化银均为化合物
②漂白粉、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、醋酸、次氯酸均为电解质
④Na2O2、Na2CO3、Na2SiO3均为钠盐.
| A、①② | B、②③ | C、③⑤ | D、①④ |
聚三溴代苯乙烯( )是性能优良的阻燃剂,其两种合成工艺如图所示.
)是性能优良的阻燃剂,其两种合成工艺如图所示.
(1)D是高分子化合物,写出D的结构简式 .
(2)写出A可能的结构简式 .
(3)写出B→C的化学方程式 .
(4)设计反应①和③的目的是 .
 )是性能优良的阻燃剂,其两种合成工艺如图所示.
)是性能优良的阻燃剂,其两种合成工艺如图所示.
(1)D是高分子化合物,写出D的结构简式
(2)写出A可能的结构简式
(3)写出B→C的化学方程式
(4)设计反应①和③的目的是
下列各组物质只用一种试剂不能全部检验出来的是( )
| A、甲苯、氯仿、己烯、酒精、苯酚水溶液、纯碱 |
| B、五瓶无色溶液:乙醇、乙醛、乙酸、葡萄糖、丙三醇 |
| C、四瓶无色液体:己烯、环己烷、溴乙烷、苯 |
| D、四瓶无色溶液:CCl4、苯乙烯、乙醇、苯酚溶液 |
下列两种物质混合、静置后,可以用分液漏斗分离的是( )
| A、酒精和水 | B、碘和汽油 |
| C、水和四氯化碳 | D、食盐和水 |
某溶液中含有Fe3+、Fe2+、Cu2+几种金属离子,然后向该溶液中加入少量铁粉,溶液中离子浓度一定增大和减少的分别是( )
| A、Fe3+、Cu2+ |
| B、Fe2+、Cu2+ |
| C、Fe2+、Fe3+ |
| D、Fe3+、Fe2+ |