题目内容
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,11.2L氯仿中含有C-Cl键的键数为1.5NA |
| B、常温下,42g丁烯和环丙烷的混合气体中含有σ键的数目为3NA |
| C、常温下,1mol SiC中含有Si-C键的数目为4NA |
| D、常温常压下,17g甲基(-14CH3)所含的中子数为9NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标准状况下,氯仿不是气体;
B、42g丁烯和环丙烷的混合气体中含有3molCH2,只是C-H含有的σ键数就为6NA;
C、在SiC中每个Si与四个C相连;
D、一个-14CH3含有14-6+3×0=8个中子.
B、42g丁烯和环丙烷的混合气体中含有3molCH2,只是C-H含有的σ键数就为6NA;
C、在SiC中每个Si与四个C相连;
D、一个-14CH3含有14-6+3×0=8个中子.
解答:
解:A、标准状况下,氯仿不是气体,因此无法计算,故A错误;
B、42g丁烯和环丙烷的混合气体中含有3molCH2,只是C-H含有的σ键数就为6NA,故B错误;
C、在SiC中每个Si与四个C相连,因此1mol SiC中含有Si-C键的物质的量为4mol,数目为4NA,故C正确;
D、17g甲基(-14CH3)的物质的量为1mol,(-14CH3)的数目为NA,一个-14CH3含有14-6+3×0=8个中子,因此所含中子数为8NA,故D错误;
故选C.
B、42g丁烯和环丙烷的混合气体中含有3molCH2,只是C-H含有的σ键数就为6NA,故B错误;
C、在SiC中每个Si与四个C相连,因此1mol SiC中含有Si-C键的物质的量为4mol,数目为4NA,故C正确;
D、17g甲基(-14CH3)的物质的量为1mol,(-14CH3)的数目为NA,一个-14CH3含有14-6+3×0=8个中子,因此所含中子数为8NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,明确标况下气体摩尔体积的使用条件、物质的结构,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
下列离子方程式中正确的是( )
| A、稀硫酸与氢氧化钡溶液反应 H++OH-=H2O |
| B、硫酸铝溶液中滴入氨水 Al3++OH-=Al(OH)3↓ |
| C、将足量CO2通入偏铝酸钠溶液中 Al3++CO2+H2O=Al(OH)3↓+CO32- |
| D、硝酸铝溶液中滴加少量氢氧化钠溶液 Al3++3OH-=Al(OH)3↓ |
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、常温常压下,16g氧气中所含的原子数为NA |
| B、0.1mol H2O和D2O组成的混合物中含有的中子数是NA |
| C、1mol CH3+(碳正离子)中含有电子数为10NA |
| D、0.1L 2 mol?L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
Fe与稀H2SO4反应制取氢气,下列措施一定能使生成氢气的速率加快的是( )
| A、增加铁的量 | B、增大硫酸的浓度 |
| C、加热 | D、增大压强 |
某温度下,将等物质的量的P与Q投入体积固定2L密闭容器中,发生反应2P(g)+Qg)?xW(g)+U(g),经5min后到达平衡,这5min内W的平均反应速率是0.2mol/(L?min),平衡时U的浓度为0.5mol/L,[P]:[Q]=1:2,下列说法中不正确的是( )
| A、x值是2 |
| B、P平衡转化率为66.7% |
| C、平衡常数为1 |
| D、反应前,Q的物质的量为3 mol |
如图,下列叙述正确的是( )
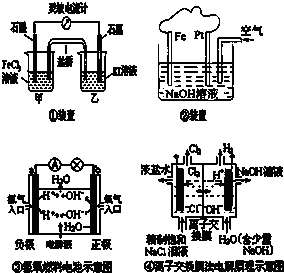

| A、①装置的总反应为2Fe3+2I-═2Fe2++I2 |
| B、②装置中Fe为阴极,电极反应为 Fe-2e-+2OH-═Fe(OH)2 |
| C、③装置中外电路电子由b极流向a极 |
| D、④装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
60g的A物质和20g的B物质完全反应,生成20g的C物质,10g的D物质,1mol的E物质,则E的摩尔质量为( )
| A、20g | B、50g/mol |
| C、50 | D、60g/mol |