题目内容
4.已知在1×105 Pa、298K条件下,2mol氢气燃烧生成水蒸气,放出484kJ热量,下列热化学方程式正确的是( )| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
分析 A、根据氢气燃烧生成水蒸气的逆过程为吸热过程来分析;
B、根据物质的聚集状态来判断;
C、根据反应放热时焓变符号为负来判断;
D、根据反应放热时焓变符号为负来判断.
解答 解:A、2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,其逆过程就要吸收这些热量,有:H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1,故A错误;
B、生成的水应该为气态,而不是液态,故B错误;
C、反应为放热反应,此时焓变符号为负,水的状态是气体符合题干要求,故C正确;
D、反应为放热反应,此时焓变符号为负,故D错误.
故选C.
点评 本题主要考查学生热化学方程式的书写原则,该题型是现在高考的热点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是( )
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| C. | 用蒸发结晶的方法从氧化后的海带灰浸取液中提取碘--蒸发皿 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
12.下列叙述中正确的是( )
| A. | 非金属氧化物都是酸性氧化物 | |
| B. | CaCO3是电解质,但CaCO3的水溶液几乎不导电 | |
| C. | 金属Al是非电解质,但金属Al能导电 | |
| D. | H2SO4(纯)是电解质,因此H2SO4(纯)能导电 |
9.下列叙述正确的是( )
| A. | NaCl的摩尔质量是58.5 g | |
| B. | 含1 mol NaCl的溶液中约含有6.02×1023个Cl- | |
| C. | 1 mol NaCl的质量是58.5 g•mol-1 | |
| D. | 58.5 g NaCl所含Na+和Cl-共1mol |
16. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成
甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的△H<0(填“>”、“<”或“=”).
②300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是CD(填字母).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃,以CH3OH表示该过程的反应速率v(CH3OH)=0.08mol/(L.min).
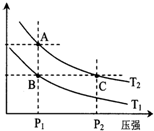
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A< C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是CD(填字母).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃,以CH3OH表示该过程的反应速率v(CH3OH)=0.08mol/(L.min).
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A< C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
13.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2O | D. | NH3 H2O CO2 |
18.下列有关胶体及其性质的叙述正确的是( )
| A. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| B. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 | |
| C. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| D. | 纳米材料 微粒直径从几纳米到几十纳米(1nm=10-9m),因此纳米材料属于胶体 |