题目内容
14.据报道,某些建筑材料会产生放射性同位素氡${\;}_{86}^{222}$Rn,从而对人体产生伤害.该同位素原子的中子数与质子数之差是( )| A. | 50 | B. | 136 | C. | 86 | D. | 222 |
分析 ${\;}_{86}^{222}$Rn中质量数为222、质子数为86,根据质量数=质子数+中子数计算出中子数,然后计算出中子数与质子数之差.
解答 解:${\;}_{86}^{222}$Rn的质量数为222、质子数为86,其中子数=质量数-质子数=222-86=136,
该同位素原子的中子数与质子数之差=136-86=50,
故选A.
点评 本题考查了质子数、中子数与质量数的关系,题目难度不大,明确质量数=质子数+中子数为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
4.在下列各溶液中,离子可能大量共存的是( )
| A. | 加入铝粉能产生H2的溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 加入Na2O2的溶液中:K+、Al3+、Cl-、NO3- | |
| C. | 含有0.1mol•L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 无色透明的酸性溶液中:MnO4-、K+、SO42-、Na+ |
2.下列有关酯化反应的说法正确的是( )
| A. | 使用过量的乙醇能使乙酸完全转化为乙酸乙脂 | |
| B. | 酯化反应时,生成的酯基个数与水分子个数相同 | |
| C. | 用过滤的方法分离乙酸乙酯和碳酸钠饱和溶液的混合物 | |
| D. | CH3CH(OH)COOH不能相互反应生成聚脂 |
9.下列说法正确的是( )
| A. | 将等体积、等pH的硫酸和醋酸分别稀释相同倍数,醋酸的pH变化大 | |
| B. | 用氯化氢作导电性实验,灯光较暗,说明氯化氢是弱电解质 | |
| C. | 向滴有酚酞的氨水中逐滴加入浓硝酸,红色褪去,说明氨水中存在电离平衡 | |
| D. | 向浓度均为0.1mol•L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀[已知:Ksp(AgCl)>Ksp(AgI)] |
19.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中“●”和“○”分别代表不同元素的原子.关于此反应说法不正确的是( )


| A. | 可能是双氧水分解反应 | |
| B. | 充分反应后,还有 物质,则属于可逆反应 物质,则属于可逆反应 | |
| C. | 反应前后,一定是共价键的断裂与生成 | |
| D. | 该反应可表示为: = = + + |
6.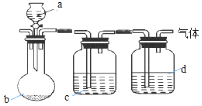 用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
 用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )| 气体 | a | b | c | d | |
| A | CO2 | 稀硫酸 | 石灰石 | 饱和Na2CO3溶液 | 浓H2SO4 |
| B | Cl2 | 浓盐酸 | KMnO4固体 | 饱和NaCl溶液 | 浓H2SO4 |
| C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 碱石灰 |
| D | H2 | 硝酸 | 锌粒 | H2O | P2O5 |
| A. | A | B. | B | C. | C | D. | D |
6.仅利用所提供实验器材(规格和数量不限),能完成相应实验的一项是( )
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、蒸发皿 | 氯化钠溶液的蒸发结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去二氧化硅中的少量碳酸钙 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体硫酸钠配制0.1 mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
7.实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:4CuI+Hg=Cu2HgI4+2Cu.下列有关说法正确的是( )
| A. | 上述反应的产物Cu2HgI4中,Hg的化合价为+2 | |
| B. | 上述反应中CuI既是氧化剂,又是还原剂 | |
| C. | 上述反应中Hg与Cu均发生氧化反应 | |
| D. | 上述反应中生成64gCu时,转移的电子数为6.02×1023 |