题目内容
13.依据不同的分类标准,HNO3可属于下列的哪一类( )①酸 ②纯净物 ③氧化物 ④含氧酸 ⑤化合物⑥混合物 ⑦一元酸.
| A. | ①②③ | B. | ①②④⑤⑦ | C. | ③④⑥ | D. | ①③④⑤⑦ |
分析 HNO3在水中电离出的阳离子只有氢离子属于酸;硝酸中含有氧元素,所以属于含氧酸;硝酸是由氢、氧、氮元素组成的纯净物,属于化合物不是氢化物;硝酸在水溶液中能能电离出一个氢离子,根据物质的分类知识回答.
解答 解:HNO3在水中电离出的阳离子只有氢离子属于酸;硝酸中含有氧元素,所以属于含氧酸;硝酸是由氢、氧、氮元素组成的纯净物,属于化合物,不是氢化物;硝酸在水溶液中能电离出一个氢离子,属于一元酸,易挥发,属于挥发性的酸,
故选B.
点评 本题主要考查物质的分类方法,解答时要分析物质的元素组成和物质组成,然后再根据各类物质概念的含义进行分析、判断,从而得出正确的结论,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列说法正确的是( )
| A. | 乙烯的电子式为  | B. | 乙烯的球棍模型为  | ||
| C. | 乙烯分子是平面结构 | D. | 乙烯的结构简式为CH2CH2 |
1.下列物质在常温下发生水解时,对应的离子方程式正确的是( )
①Na2CO3:CO32-+2H2O?H2O+CO2↑+2OH-
②NH4Cl:NH4++H2O?NH3•H2O+H+
③CuSO4:Cu2++2H2O?Cu(OH)2+2H+
④NaF:F-+H2O═HF+OH-.
①Na2CO3:CO32-+2H2O?H2O+CO2↑+2OH-
②NH4Cl:NH4++H2O?NH3•H2O+H+
③CuSO4:Cu2++2H2O?Cu(OH)2+2H+
④NaF:F-+H2O═HF+OH-.
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
18.下列对于太阳能、生物质能和氢能的利用的说法不正确的是( )
| A. | 芒硝晶体(Na2SO4•10H2O)白天在阳光下曝晒后失水、溶解吸热,夜里重新结晶放热,实现了太阳能转化为化学能继而转化为热能 | |
| B. | 将植物的秸秆、枝叶、杂草和人畜粪便加入沼气发酵池中,在富氧条件下,经过缓慢、复杂、充分的氧化反应最终生成沼气,从而有效利用生物质能 | |
| C. | 生活、生成中大量应用氢能源,首先要解决由水制备氢气的能耗、氢气的储存和运输等问题 | |
| D. | 垃圾焚烧处理厂把大量生活垃圾中的生物质能转化为热能、电能,减轻了垃圾给城市造成的压力,改善了城市的环境,增强了市民的环保意识 |
5.硫代硫酸钠与稀硫酸反应的方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O某学习小组为研究反应物浓度和温度对该反应速率的影响,设计以下3组实验下列说法不正确的是( )
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| Ⅰ | 25 | 5 | 0.2 | 10 | 0.1 | x |
| Ⅱ | 25 | 10 | 0.1 | 10 | 0.2 | 5 |
| Ⅲ | 35 | 10 | 0.1 | 5 | y | 10 |
| A. | 该反应所需的仪器有:量筒、温度计、秒表、烧杯 | |
| B. | 通过记录产生淡黄色沉淀所需的时间可以比较反应的快慢 | |
| C. | 比实验 II、III研究温度对该反应速率的影响,则y=0.2 | |
| D. | 对比实验 I、II研究C(H+)对该反应速率的影响,则x=10 |
2.用NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5molC3H8分子中所含C-H共价键数为2NA | |
| C. | 标准状况下,22.4L乙醇完全燃烧所消耗的氧气分子数为3NA | |
| D. | 1molCH5+离子所含的电子数为11NA |
3.利用锌锰干电池内的黑色固体水浸后的碳包滤渣(含MnO2、C、Hg2+等)制取MnSO4•H2O 的实验流程如图:

已知:25℃时,几种硫化物的溶度积常数如表:
25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
(1)上述流程中,蒸发实验操作时用到的硅酸盐材质的仪器有蒸发皿、玻璃棒、酒精灯.
(2)在加热条件下“浸取”,其原因是加快浸取时的反应速率;浸取时生成MnSO4和Fe2(SO4)3的化学方程式为9MnO2+2FeS+10H2SO4=9MnSO4+Fe2(SO4)3+10H2O.
(3)滤渣I的成分为MnO2、C和HgS(填化学式);若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的$\frac{c(H{g}_{2}^{+})}{C(F{e}_{2}^{+})}$=4.4×10-37(填数值).
(4)“氧化”时的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;氧化时可用H2O2代替MnO2,H2O2的电子式为 .
.
(5)中和时,应该调节溶液pH的范围到3.7≤pH<8.3.

已知:25℃时,几种硫化物的溶度积常数如表:
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5.0×l0-18 | 4.6×l0-14 | 2.2×l0-54 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(2)在加热条件下“浸取”,其原因是加快浸取时的反应速率;浸取时生成MnSO4和Fe2(SO4)3的化学方程式为9MnO2+2FeS+10H2SO4=9MnSO4+Fe2(SO4)3+10H2O.
(3)滤渣I的成分为MnO2、C和HgS(填化学式);若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的$\frac{c(H{g}_{2}^{+})}{C(F{e}_{2}^{+})}$=4.4×10-37(填数值).
(4)“氧化”时的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;氧化时可用H2O2代替MnO2,H2O2的电子式为
 .
.(5)中和时,应该调节溶液pH的范围到3.7≤pH<8.3.
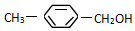 类别醇类或芳香醇.官能团的结构简式-OH名称羟基.
类别醇类或芳香醇.官能团的结构简式-OH名称羟基.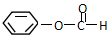 类别酯类.官能团的结构简式-COOC-名称酯基.
类别酯类.官能团的结构简式-COOC-名称酯基.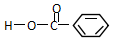 类别羧酸或芳香酸.官能团的结构简式-COOH名称羧基.
类别羧酸或芳香酸.官能团的结构简式-COOH名称羧基.