题目内容
5. 利用如图装置,写出除去下列物质中的杂质的方法,并写出化学方程式(括号内的气体为杂质).
利用如图装置,写出除去下列物质中的杂质的方法,并写出化学方程式(括号内的气体为杂质).(1)CO2( SO2)饱和NaHCO3溶液,化学方程式SO2+2NaHCO3=Na2SO3+2CO2+H2O.
(2)SO2 ( HCl )饱和NaHSO3溶液,化学方程式NaHSO3+HCl=NaCl+SO2↑+H2O.
分析 (1)二氧化碳与饱和碳酸氢钠不反应,二氧化硫与碳酸氢钠反应生成二氧化碳;
(2)HCl与饱和亚硫酸氢钠反应生成二氧化硫.
解答 解:(1)将混和气体通入到盛有饱和NaHCO3溶液的上图装置中,化学方程式是:SO2+2NaHCO3=2CO2↑+Na2SO3+H2O,
故答案为:饱和NaHCO3溶液;SO2+2NaHCO3=Na2SO3+2CO2+H2O;
(2)HCl与饱和亚硫酸氢钠反应生成二氧化硫,选择试剂为饱和NaHSO3溶液,化学方程式是NaHSO3+HCl=NaCl+SO2↑+H2O,故答案为:饱和NaHSO3溶液;NaHSO3+HCl=NaCl+SO2↑+H2O.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析能力、实验能力和评价能力的考查,难度不大,注意把握物质的性质的异同,注意除杂时不能引入新的杂质.

练习册系列答案
相关题目
19.在一密闭容器中,反应 aA(气)?bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的65%,则下列说法正确的是( )
| A. | 平衡常数减小 | B. | 物质A的转化率增加了 | ||
| C. | 平衡向逆反应方向移动了 | D. | a>b |
13.等体积的两容器内,一个盛CH4,另一个盛NH3,若容器内温度、压强相同,则两容器内所盛气体比较,结论一定不正确的是( )
| A. | 分子个数比为1:1 | B. | 原子个数比为5:4 | ||
| C. | 质量比为17:16 | D. | 氢原子个数比为4:3 |
20.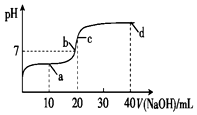 室温时,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.下列说法正确的是( )
室温时,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.下列说法正确的是( )
 室温时,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.下列说法正确的是( )
室温时,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.下列说法正确的是( )| A. | a点:c(HA)>c(A-) | B. | b点:c(Na+)=c(A-)+c(HA) | ||
| C. | c点:c(H+)+c(HA)=c(OH-) | D. | d点:c(Na+)>c(A-)>c(OH-)>c(H+) |
15.如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是( )
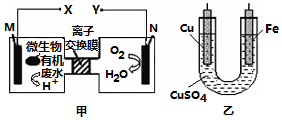

| A. | 质子透过离子交换膜由右向左移动 | |
| B. | 铜电极应与X相连接 | |
| C. | M电极反应式:(C6H10O5)n+7nH2O-24ne-═6nCO2↑+24n H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g |


