题目内容
已知X、Y是主族元素,I为电离能,单位是KJ/mol.根据下表所列数据判断错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11600 |
| A、元素Y的常见化合价是+3价 |
| B、元素X是ⅠA族的元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、若元素Y处于第3周期,Mg(OH)2碱性弱于Y(OH)m |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:由电离能数据可知,X的第二电离能剧增,故X可失去1个电子,原子最外层电子数为1,Y的第四电离能剧增,故Y可失去3个电子,原子最外层有3个电子,结合元素化合物性质与元素周期律解答.
解答:
解:由电离能数据可知,X的第二电离能剧增,故X可失去1个电子,原子最外层电子数为1,Y的第四电离能剧增,故Y可失去3个电子,原子最外层有3个电子,
A.的第四电离能剧增,故Y可失去3个电子,原子最外层有3个电子,元素Y的常见化合价是+3价,故A正确;
B.X的第二电离能剧增,故X可失去1个电子,原子最外层电子数为1,故主族元素X处于ⅠA族,故B正确;
C.X可失去1个电子,化合价为+1,与氯形成化合物时,化学式可能是XCl,故C正确;
D.若元素Y处于第3周期,则为Al,金属性比Mg弱,故进行Mg(OH)2>Al(OH)3,故D错误,
故选D.
A.的第四电离能剧增,故Y可失去3个电子,原子最外层有3个电子,元素Y的常见化合价是+3价,故A正确;
B.X的第二电离能剧增,故X可失去1个电子,原子最外层电子数为1,故主族元素X处于ⅠA族,故B正确;
C.X可失去1个电子,化合价为+1,与氯形成化合物时,化学式可能是XCl,故C正确;
D.若元素Y处于第3周期,则为Al,金属性比Mg弱,故进行Mg(OH)2>Al(OH)3,故D错误,
故选D.
点评:本题考查元素的电离能知识,题目难度不大,注意理解电离能与核外最外层电子数、化合价的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列叙述中正确的是( )
| A、构成原电池正极和负极的材料必须是两种金属 |
| B、由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 |
| C、马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀 |
| D、镁.铝作电极,与硫酸构成原电池,电流由铝经导线流向镁 |
 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A、Y、W的最简单氢化物的水溶液都呈酸性 |
| B、X、Y与Z中的任意两种元素均可形成两种或两种以上的化合物 |
| C、上述四种元素形成的化合物都抑制水的电离 |
| D、W的单质可从Z的最简单氢化物中置换出Z的单质 |
下列说法不正确的是( )
| A、化学反应的速率越大,化学反应的限度越大 |
| B、化学反应中既有物质变化,又有能量变化 |
| C、化学反应的实质是旧键的断裂,新键的形成 |
| D、可逆反应达到化学平衡状态,反应依然在进行 |
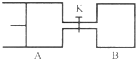 如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K一段时间达到平衡时,A的体积为0.8aL(连通管中气体体积不计) |
| D、打开K达到新平衡后,升高B容器温度,A容器体积一定减小 |
甲、乙两个烧杯中分别加入含等物质的量的硫酸溶液,向甲中加入mgMg,向乙中加入mgZn,反应结束后,一烧杯中仍有金属未溶解,则甲、乙两个烧杯中含硫酸的物质的量(n)的值是( )
A、
| ||||
B、n=
| ||||
C、m/65<n=
| ||||
D、
|
 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g,试回答:
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g,试回答: A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.