题目内容
氯化硼的熔点为10.7℃,沸点为12.5℃.在氯化硼分子中,Cl-B-Cl键角为120°,它可以水解,水解产物之一是氯化氢.下列对氯化硼的叙述中正确的是( )
| A、氯化硼是原子晶体 |
| B、熔化时,氯化硼能导电 |
| C、氯化硼分子是一种非极性分子 |
| D、氯化硼水解得到两种酸 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A.根据分子晶体的物理性质分析;
B.三氯化硼属于共价化合物;
C.三氯化硼的分子结构对称,正负电荷中心重叠;
D.三氯化硼水解生成HCl.
B.三氯化硼属于共价化合物;
C.三氯化硼的分子结构对称,正负电荷中心重叠;
D.三氯化硼水解生成HCl.
解答:
解:A.氯化硼(BCl3)的熔点为-107℃,沸点为12.5℃,所以氯化硼晶体为分子晶体,故A错误;
B.氯化硼是共价化合物,液态时不能导电,固态时也不导电,故B错误;
C.三氯化硼的结构对称,正负电荷的中心重叠,分子没有极性,属于非极性分子,故C正确;
D.三氯化硼水解生成的HCl和硼酸,所以将氯化硼加到水中,其水溶液显酸性,故D正确.
故选:CD.
B.氯化硼是共价化合物,液态时不能导电,固态时也不导电,故B错误;
C.三氯化硼的结构对称,正负电荷的中心重叠,分子没有极性,属于非极性分子,故C正确;
D.三氯化硼水解生成的HCl和硼酸,所以将氯化硼加到水中,其水溶液显酸性,故D正确.
故选:CD.
点评:本题考查共价化合物的性质、分子极性的判断等,难度不大,注意分子晶体与原子晶体性质的差别.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
下列分子式表示的物质,具有同分异构体的是( )
| A、C3H6 |
| B、C3H8 |
| C、CH2Cl2 |
| D、C2H4 |
将a、b、c、d 4种金属两两连接浸入电解质溶液中,组成4个原电池(如图):
①中a极发生氧化反应 ②中电流由b到c ③中c极质量增加 ④中a极有大量气泡,则4种金属的活泼性由强到弱的顺序为( )
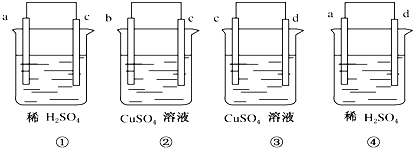
①中a极发生氧化反应 ②中电流由b到c ③中c极质量增加 ④中a极有大量气泡,则4种金属的活泼性由强到弱的顺序为( )

| A、d>a>c>b |
| B、b>d>c>a |
| C、d>c>a>b |
| D、a>d>b>c |
下列物质中属于非电解质的是( )
| A、乙醇 |
| B、O2 |
| C、Na2CO3 |
| D、NaOH |
 3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )
3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )| A、图中C表示生成物NH3(g)的总能量 |
| B、断裂3molH-H和1mol N≡N所吸收的总能量大于形成6mol N-H所释放的总能量 |
| C、逆反应的活化能E(逆)=E+△H |
| D、3 H2(g)+N2(g)?2NH3(g)△H<0 |
只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物.下列物质不属于氢化物的是( )
| A、H2O |
| B、H2SO4 |
| C、NaH |
| D、NH3 |
 现有8种元素,其中A、B、C、D、E为短周期主族元素,F、G、H为第4周期元素,其原子序数依次增大.请根据下列相关信息,回答问题.
现有8种元素,其中A、B、C、D、E为短周期主族元素,F、G、H为第4周期元素,其原子序数依次增大.请根据下列相关信息,回答问题.