题目内容
将a、b、c、d 4种金属两两连接浸入电解质溶液中,组成4个原电池(如图):
①中a极发生氧化反应 ②中电流由b到c ③中c极质量增加 ④中a极有大量气泡,则4种金属的活泼性由强到弱的顺序为( )
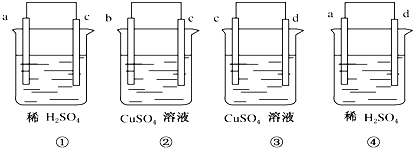
①中a极发生氧化反应 ②中电流由b到c ③中c极质量增加 ④中a极有大量气泡,则4种金属的活泼性由强到弱的顺序为( )

| A、d>a>c>b |
| B、b>d>c>a |
| C、d>c>a>b |
| D、a>d>b>c |
考点:原电池和电解池的工作原理
专题:
分析:原电池中作负极的金属是活动性强的金属,即金属的活动性:负极>正极,根据题中电极上的现象判断正负极,再比较金属性强弱.
解答:
解:①中a极发生氧化反应,则a失电子为负极,c为正极,所以金属活动性a>c;
②原电池中电流从正极流向负极,电流由b到c,则b为正极,c为负极,所以金属活动性c>b;
③中c极质量增加,则c上析出金属,c为正极,所以d为负极,所以金属活动性d>c;
④中a极有大量气泡,则a为正极,d为负极,所以金属活动性d>a;
所以它们的活动性由强到弱的顺序是d>a>c>b,
故选A.
②原电池中电流从正极流向负极,电流由b到c,则b为正极,c为负极,所以金属活动性c>b;
③中c极质量增加,则c上析出金属,c为正极,所以d为负极,所以金属活动性d>c;
④中a极有大量气泡,则a为正极,d为负极,所以金属活动性d>a;
所以它们的活动性由强到弱的顺序是d>a>c>b,
故选A.
点评:本题考查了金属活泼性强弱的判断,难度不大,金属活泼性强弱的判断方法有:原电池中的正负极材料、金属之间的置换反应、金属和酸反应置换出氢气的难易等,该题考查了原电池中通过正负极的判断来比较金属性.

练习册系列答案
相关题目
家用消毒液的发生器是以精盐和自来水为反应物,通电时,发生器的电解槽的极板上产生大量气泡,切断电源后,生成液具有强烈的杀菌消毒能力.与该反应器工作原理直接有关的化学方程式是( )
| A、2NaOH+Cl2═NaCl+NaClO+H2O |
| B、H2+Cl2═2HCl |
| C、2NaCl(熔融)=2Na+Cl2↑ |
| D、2HClO═2HCl+O2↑ |
在强酸性溶液中下列离子能大量共存的是( )
| A、Ca2+、Na+、OH-、CO32- |
| B、Ag+、SO42-、HCO3-、Cl- |
| C、Cu2+、Na+、SO42-、NO3- |
| D、NH4+、S2-、Mg2+、Cu2+ |
将适量的MO2粉末投入热水中,一边搅拌,一边通入SO2气体,结果得到白色不溶物X,已知X既是氧化产物又是还原产物.下列判断错误的是( )
①MO2具有氧化性②白色不溶物X为MSO2③白色不溶物X为MSO4④白色不溶物X为MS.
①MO2具有氧化性②白色不溶物X为MSO2③白色不溶物X为MSO4④白色不溶物X为MS.
| A、①② | B、③④ | C、②④ | D、①③ |
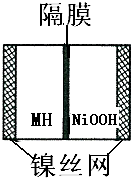 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )| A、放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、电池的电解液可为稀H2SO4溶液 |
| C、充电时负极反应为:MH+OH--e-═H2O+M |
| D、MH是一类储氢材料,其所含氢密度越大,电池的能量密度越高 |
氯化硼的熔点为10.7℃,沸点为12.5℃.在氯化硼分子中,Cl-B-Cl键角为120°,它可以水解,水解产物之一是氯化氢.下列对氯化硼的叙述中正确的是( )
| A、氯化硼是原子晶体 |
| B、熔化时,氯化硼能导电 |
| C、氯化硼分子是一种非极性分子 |
| D、氯化硼水解得到两种酸 |