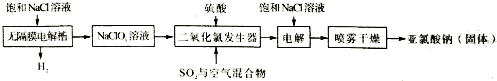
题目内容
2. 某温度下在2L密闭容器中加人一定量A,发生以下化学反应:
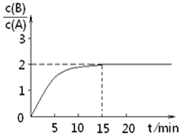
某温度下在2L密闭容器中加人一定量A,发生以下化学反应:2A(g)?B(g)+C(g)△H=-48.25kJ/mol.反应过程中B、A的浓度比与时间t有图所示关系,若测得第15min时c(B)=1.6mol/L,下列结论正确的是( )
| A. | 反应达平衡时,A的转化率为80% | |
| B. | A的初始物质的量为4mol | |
| C. | 反应到达平衡时,放出的热量是193kJ | |
| D. | 15min时,v正=v逆=0 |
分析 由图可知,15min时反应到达平衡,平衡时c(B)=1.6mol•L-1,$\frac{c(B)}{c(A)}$=2,故平衡时c(A)=0.8mol/L,因反应前后气体的物质的量不变,则可计算转化率、A的初始物质的量,以此解答该题.
解答 解:由图可知,15min时反应到达平衡,平衡时c(B)=1.6mol•L-1,$\frac{c(B)}{c(A)}$=2,故平衡时c(A)=0.8mol/L,浓度变化量之比等于化学计量数之比,故△c(A)=2c(B)=2×1.6mol•L-1=3.2mol•L-1,A的起始浓度为3.2mol•L-1+0.8mol/L=4mol/L,故A的初始物质的量为4mol/L×2L=8 mol,
A.反应达平衡时,A的转化率为$\frac{3.2mol/L}{4mol/L}×100%$=80%,故A正确;
B.由以上分析可知A的初始物质的量为8mol,故B错误;
C.参加反应的A的物质的量为3.2mol/L×2L=6.4mol,故放出的热量为48.25kJ×$\frac{6.4mol}{2}$=154.4kJ,故C错误;
D.15min时达到平衡状态,但反应速率不等于0,故D错误.
故选A.
点评 本题考查化学平衡图象、有关计算、影响平衡的因素等,为高频考点,侧重于学生的分析、计算能量的考查,注意D选项,反应前后气体的体积不变,只降低A的浓度所到达的平衡状态与原平衡状态为等效平衡,$\frac{c(B)}{c(A)}$值不变.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15. 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是催化剂、吸水剂;
(2)球形干燥管C的作用是防止倒吸反应结束后D中的现象是溶液分层,上层为无色油状液体
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇,然后在混合液中加入沸石(或碎瓷片)再加热进行蒸馏,收集77℃左右的馏分,以得一较纯净的乙酸乙酯.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是催化剂、吸水剂;
(2)球形干燥管C的作用是防止倒吸反应结束后D中的现象是溶液分层,上层为无色油状液体
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇,然后在混合液中加入沸石(或碎瓷片)再加热进行蒸馏,收集77℃左右的馏分,以得一较纯净的乙酸乙酯.
16.下列水处理剂的工作原理与胶体有关的是( )
| A. | 活性炭 | B. | 氯气 | C. | 明矾 | D. | 次氯酸钠 |
13.下列那些物质在融化状态下可以导电( )
| A. | HCl | B. | NH4Cl | C. | NaHSO4 | D. | H2SO4 |
20.将1mol•L-1NaOH溶液与3mol•L-1NaOH溶液等体积混合,此溶液的物质的量浓度是( )
| A. | 1mol•L-1 | B. | 3mol•L-1 | C. | 2mol•L-1 | D. | 4mol•L-1 |
7.T℃时,体积均为0.5L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g)?2C(g)△H=-Q kJ/mol (Q>0).保持温度不变,实验测得起始和平衡时的有关数据如下表:
下列叙述中正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为18 | |
| B. | 容器②中达到平衡时放出的热量为0.05Q kJ | |
| C. | 向容器①中通入氦气,平衡时A的转化率增大 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3 |
14.在4L密闭容器中充入6molA(g) 和5molB(g) 在一定温度下发生反应:3A(g)+B(g)?2C(g)+xD(g),达到平衡时,生成2molC,测得D的浓度为0.5mol/L,则下列判断正确的是( )
| A. | x=1 | |
| B. | 平衡时A的浓度为1.5 mol/L | |
| C. | B的转化率为20% | |
| D. | 反应起始和达到平衡时,混合气体的压强比为4:5 |
12. 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):
根据实验数据求:
(1)实验完毕后,生成物中水的质量为1.8 g,假设广口瓶里生成一种正盐,其质量为5 g;
(2)生成的水中氢元素的质量为0.2 g;
(3)生成的二氧化碳中碳元素的质量为0.6 g;
(4)该燃料中碳元素与氢元素的质量比为3:1;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为CH4O,结构简式为CH3OH.
 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
(1)实验完毕后,生成物中水的质量为1.8 g,假设广口瓶里生成一种正盐,其质量为5 g;
(2)生成的水中氢元素的质量为0.2 g;
(3)生成的二氧化碳中碳元素的质量为0.6 g;
(4)该燃料中碳元素与氢元素的质量比为3:1;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为CH4O,结构简式为CH3OH.