��Ŀ����
3��25��ʱ�����볣��Ka��HF��=3.6��10-4���ܶȻ�Ksp��CaF2��=1.46��10-10��Ksp��AgCl��=4��10-10��Ksp��AgI��=1.0��10-16������˵����ȷ���ǣ�������| A�� | 25��ʱ��0.1mol•L-1HF��Һ��pH=1 | |
| B�� | ��AgI������Һ�м���NaCl��Һ��������AgCl�������� | |
| C�� | 25��ʱ��ʹAgClת��ΪAgI�������KI��Һ��Ũ�Ȳ�����5��10-12mol/L | |
| D�� | ��1L 0.1mol/LHF��Һ�м���1L 0.1mol/LCaCl2��Һ��û�г������� |
���� A��HFΪ���ᣬ������ȫ���룻
B���ܽ��С��ת��Ϊ�ܽ�ȸ�С������ʵ�֣�
C������Ksp��AgCl�����c��Ag+����������Ksp��AgI����������ӵ�Ũ�ȣ�
D����Ksp��CaF2����Qc��CaF2���жϣ�
��� �⣺A��HFΪ���ᣬ������ȫ���룬���Գ�����O��1 mol•L-1HF��ҺpH��l����A����
B��AgCl���ܣ�����AgI�ܽ�ȸ�С������AgCl��ת��ΪAgI����B����
C����Ksp��AgCl��=4��10-10����c��Ag+��=$\sqrt{Ksp��AgCl��}$=$\sqrt{4��1{0}^{-10}}$=2.0��10-5mol/L��c��I-��=$\frac{Ksp��AgI��}{c��A{g}^{+}��}$=$\frac{1.0��1{0}^{-16}}{2.0��1{0}^{-5}}$=5��10-12mol/L�����Լ���KI��Һ��Ũ�Ȳ�����5��10-12 mol/L����C��ȷ��
D����1L0.1 mol•L-1HF��Һ�м���1L 0.1 mol•L-1CaCl2��Һ��Qc��CaF2��=0.05��0.052=1.25��10-4��Ksp��CaF2��=1.46��10-10���г������ɣ���D����
��ѡC��
���� ���⿼�����ܵ���ʵ��ܽ�ƽ�⣬Ϊ��Ƶ���㣬�����ܶȻ������ļ��㼰Ӧ��Ϊ���Ĺؼ������ط��������ͼ��������Ŀ��飬��Ŀ�Ѷ��еȣ�

 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д� ��������������������λ��ѧ�����о������ӻ����������ϳɡ����2016��ŵ������ѧ����������һ�ַ��ӻ����ġ����ӡ����ϳ�����Ļ���ԭ����CH2C12����ϩ���촼����������˵������ȷ���ǣ�������
��������������������λ��ѧ�����о������ӻ����������ϳɡ����2016��ŵ������ѧ����������һ�ַ��ӻ����ġ����ӡ����ϳ�����Ļ���ԭ����CH2C12����ϩ���촼����������˵������ȷ���ǣ�������| A�� | CH2C12������ͬ���칹�� | |
| B�� | ��ϩ��ʹ��ˮ��ɫ | |
| C�� | �촼��һ���������������ᷢ��������Ӧ | |
| D�� | �����������������������»ᷢ���ӳɷ�Ӧ���ɻ����� |
| A�� | �Ȼ�þ��Һ | B�� | ��������������Һ | ||
| C�� | ���� | D�� | ����ͭ��Һ |
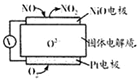
| A�� | O2-�������ƶ� | |
| B�� | �����ĵ缫��ӦʽΪ��NO-2e-+O2-�TNO2 | |
| C�� | O2�ĵ缫��Ӧ������H2O | |
| D�� | ��Ӧ���ĵ�NO��O2�����ʵ���֮��Ϊl��2 |
| A�� | ���Ӽ� | B�� | �Ǽ��Լ� | C�� | ��λ�� | D�� | ��� |
| A�� | ����MgCl2��Һ | B�� | ��������NaOH | C�� | ����NH4NO3��Һ | D�� | ����K2S��Һ |

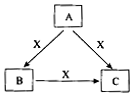 A��B��C��X����ѧ��ѧ������������ɶ�����Ԫ����ɣ�ת����ϵ��ͼ��ʾ�� ��A��B��C����ɫ��Ӧ���ʻ�ɫ��ˮ��Һ��Ϊ���ԣ�
A��B��C��X����ѧ��ѧ������������ɶ�����Ԫ����ɣ�ת����ϵ��ͼ��ʾ�� ��A��B��C����ɫ��Ӧ���ʻ�ɫ��ˮ��Һ��Ϊ���ԣ�