题目内容
5.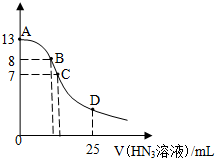 常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )
常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )| A. | A点水电离出的c(H+)小于B点 | |
| B. | 在B点,离子浓度大小为 c(OH-)>c(H+)>c(Na+)>c(N3-) | |
| C. | 在C点,滴加的V(HN3)=12.5mL | |
| D. | 在D点,c(H+)≈10-4.7 |
分析 A.A点为氢氧化钠溶液,B点为氢氧化钠和NaN3的混合液,氢氧化钠浓度越小,水的电离程度越大;
B.B点呈碱性,则c(OH-)>c(H+),由于pH=8,氢离子、氢氧根离子浓度较小,则c(Na+)>c(N3-)>c(OH-)>c(H+);
C.当加入12.5mLHN3(叠氮酸)溶液时,恰好反应生成NaN3,N3-部分水解,溶液呈碱性;
D.根据D点V(HN3)=25 mL,所以得到等物质量浓度的NaN3和HN3,以HN3的电离为主溶液呈酸性.
解答 解:A.A点为氢氧化钠溶液,氢氧化钠浓度越大,水的电离程度越小,B点为氢氧化钠和NaN3的混合液,N3-水解促进了水的电离,则水电离出的c(H+):A点小于B点,故A正确;
B.B点呈碱性,则c(OH-)>c(H+),由于pH=8,混合液中的氢离子、氢氧根离子浓度较小,则正确的离子浓度大小为:c(Na+)>c(N3-)>c(OH-)>c(H+),故B错误;
C.滴加的V(HN3)=12.5 mL时,恰好反应生成NaN3,N3-部分水解,溶液呈碱性,而C点溶液的pH=7,所以C点V(HN3)>12.5 mL,故C错误;
D.根据D点V(HN3)=25 mL,所以得到等物质量浓度的NaN3和HN3,以HN3的电离为主溶液呈酸性,而N3-对叠氮酸的电离起抑制作用,所以c(H+)≈$\sqrt{1{0}^{-4.7}}$,故D错误;
故选A.
点评 本题考查了酸碱混合的定性判断及溶液pH计算、离子浓度大小比较,题目难度中等,明确图象曲线对应溶质组成为解答关键,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒及盐的水解原理判断离子浓度大小,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
1.已知2SO2(g)+O2(g)?2SO3(g)为放热反应,对该反应的下列说法中正确的是( )
| A. | 1mol O2(g)的能量一定高于2mol SO2(g)的能量 | |
| B. | 2mol SO2(g)和1mol O2(g)的总能量一定高于2mol SO3(g)的总能量 | |
| C. | 2mol SO2(g)的能量一定高于2mol SO3(g)的能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
13.硒是人体必须的微量元素,下列关于${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se的说法正确的是( )
| A. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se都含有34个中子 | |
| B. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| C. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se因含有相同的质子数故互为同位素 | |
| D. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se含有相同的电子数,因此性质一样 |
20.短周期元素A、B、C、D的原子序数依次增大.它们的原子序数之和为36,且原子的最外层电子数之和为14; A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D分别为同主族元素.下列叙述正确的是( )
| A. | 在地壳中,B元素的含量位于第二位 | |
| B. | C元素的单质熔点低,在空气中加热时先熔化后燃烧 | |
| C. | A、B、D三种元素形成的化合物一定是强酸 | |
| D. | B元素与A元素形成的物质一定是纯净物 |
10.下列实验操作中有错误的是( )
| A. | 用蒸馏水润湿的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 蒸馏操作时,冷却水应从冷凝管的下口通入,上口流出 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,当有较多晶体析出时,停止加热 |
14.甲酸的下列性质中,不能证明它是弱电解质的是( )
| A. | 常温下,1 mol•L-1甲酸溶液的pH值约为2 | |
| B. | 甲酸电离出的阳离子全部是H+ | |
| C. | 10mL1 mol•L-1甲酸与10 mL1 mol•L-1NaOH溶液完全反应后,溶液呈碱性 | |
| D. | 1LH+浓度为0.1 mol•L-1的甲酸和足量Zn反应放出的H2在标况下远大于1.12L |
15. T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
(1)TY2是一种常用的溶剂,是非极性分子(填极性分子或非极性分子),1mol TY2中存在2NA个σ键.
(2)写出X与NaOH溶液反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)Z的基态原子核外电子排布式为1s22s22p63s23p63d104s1,ZYO4溶液常作电镀液,其中YO42-的空间构型是正四面体.
(4)将WH3的水溶液逐滴滴加到ZYO4溶液中,现象为首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色的透明溶液,相应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;.
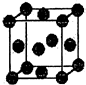
(5)已知Z的晶胞结构如图所示,该晶体的原子堆积模型为面心立方最密堆积,又知Z的密度为ρg/cm3,则晶胞边长为$\root{3}{\frac{256}{ρ{N}_{A}}}$ cm(用含p代数式表示).
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有三个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(2)写出X与NaOH溶液反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)Z的基态原子核外电子排布式为1s22s22p63s23p63d104s1,ZYO4溶液常作电镀液,其中YO42-的空间构型是正四面体.
(4)将WH3的水溶液逐滴滴加到ZYO4溶液中,现象为首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色的透明溶液,相应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;.
(5)已知Z的晶胞结构如图所示,该晶体的原子堆积模型为面心立方最密堆积,又知Z的密度为ρg/cm3,则晶胞边长为$\root{3}{\frac{256}{ρ{N}_{A}}}$ cm(用含p代数式表示).
 ;
; ;
; .
.