题目内容
18.下列实验说法正确的是( )| A. | 将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 | |
| B. | 2mL10%的NaOH溶液中滴加2%的CuSO4溶液4~6滴制得新制氢氧化铜 | |
| C. | 将水蒸气通过灼热的铁粉,铁粉变红棕色,说明铁与水在高温下能发生反应 | |
| D. | 取a克Na2CO3和NaHCO3混合物与少量稀盐酸充分反应,加热、蒸干、灼烧至熔化,冷却得b克固体,可测得Na2CO3质量分数 |
分析 A.硫酸铝在水中水解生成氢氧化铝和硫酸,硫酸为难挥发性酸;
B.确保氢氧化钠过量,氢氧化铜呈悬浊状;
C.高温下铁与水蒸气反应生成黑色固体;
D.应与足量盐酸反应.
解答 解:A.硫酸铝在水中水解生成氢氧化铝和硫酸,硫酸为难挥发性酸,所以最终得到的产物是硫酸铝,故A错误;
B.配制氢氧化铜悬浊液时NaOH一定要过量,否则氢氧化铜受热会分解生成黑色的氧化铜,故B正确;
C.高温下铁与水蒸气反应生成四氧化三铁,为黑色固体,故C错误;
D.应与足量盐酸反应,少量稀盐酸无法确定成分,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及盐类的水解、物质的制备以及物质含量的测定等知识,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1molCH5+中含有的电子数目为11NA | |
| B. | 0.1mol/L AlCl3溶液中含有的Al3+数目一定小于0.1NA | |
| C. | 78gNa2O2和Na2S的混合物中含有的阴离子数目一定是NA | |
| D. | 常温下,1L PH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA |
9.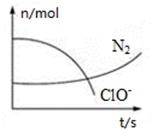 某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )
某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )
 某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )
某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )| A. | 氧化剂是ClO-,还原产物是HCO3- | |
| B. | 反应体系中反应物与生成物各有三种微粒 | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 生成2.24L N2(标准状况)时转移电子0.5 mol |
6.将6.54g氧化铜与石墨的混合粉末隔绝空气加热,充分反应后,生成的气体用足量的NaOH溶液吸收,溶液增重1.32g.则原混合粉末中氧化铜的质量可能是( )
| A. | 2.4g | B. | 4.8g | C. | 6g | D. | 6.18g |
13.工业生产措施中,能同时提高反应速率和产率的是( )
| A. | 合成氨使用高压 | B. | 制硝酸用Pt-Rh合金作催化剂 | ||
| C. | 制硫酸时接触室使用较高温度 | D. | 侯氏制碱法循环利用母液 |
10.向20mL 0.1mol/L NH4HSO4溶液中滴入0.1mol/L NaOH溶液至恰好反应完全,下列说法正确的是( )
| A. | 当滴入20mL NaOH溶液时:2c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| D. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+2c(SO42-) |
7.设NA表示阿伏加德罗常数的数值,下列叙述不正确的是( )
| A. | 1.5 g甲基所含有的电子数目为0.9NA | |
| B. | 在1L0.1 mol•L-1Na2S溶液中,阴离子总数大于0.1NA | |
| C. | 78g Na2O2与足量CO2完全反应,转移的电子总数为NA | |
| D. | 在KIO3+6HI=KI+3I2+3H2O反应中,每生成3 molI2,则转移6NA个电子 |
8.某稀溶液中含有4mol KNO3和2.5mol H2SO4,向其中加入1.5mol Fe,充分反应(已知NO3-被还原为NO).下列说法正确的是( )
| A. | 反应后生成NO的体积为28 L | B. | 所得溶液中c(Fe2+):c(Fe3+)=1:1 | ||
| C. | 所得溶液中c(NO3-)=2.75 mol/L | D. | 所得溶液中的溶质只有FeSO4 |