题目内容
13.25℃时纯水的电离程度为α1,pH=2的醋酸溶液中水的电离程度为α2,pH=12的氢氧化钠溶液中水的电离程度为α3.若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离程度为α4.下列关系式中正确的是( )| A. | α2=α3<α4<α1 | B. | α3=α2<α1<α4 | C. | α2<α3<α1<α4 | D. | α1<α2<α3<α4 |
分析 C(H+)•C(OH-)=Kw,纯水溶液中氢离子浓度始终等于氢氧根离子浓度,温度不变,水的离子积常数不变.
在25℃时,纯水的电离度为α1,水电离出的c(H+)=c(OH-)=1×10-7mol•L-1;
pH=2的醋酸中C(H+)=10-2mol/L,水的电离,根据Kw=C(H+)•C(OH-)=10-14,求得水电离出的C(H+)=C(OH-)=10-13mol/L,水的电离度为α2;
pH=12的氢氧化钠溶液中C(H+)=10-12mol/L,水电离出的C(H+)=C(OH-)=10-12mol/L,水的电离度为α3;
pH=2的醋酸和pH=12的氢氧化钠按等体积混合,CH3COOH+NaOH═CH3COONa+H2O,混合后显酸性,所得溶液中水的电离度为α4,据此分析解答.
解答 解:在25℃时,纯水中H2O?H++OH-,Kw=C(H+)•C(OH-)=10-14,所以水电离出的c(H+)=c(OH-)=1×10-7mol•L-1,纯水的电离度为α1;
pH=2的醋酸中C(H+)=10-2mol/L,水的电离,根据Kw=C(H+)•C(OH-)=10-14,所以溶液中C(OH-)=$\frac{{K}_{w}}{C({H}^{+})}$=10-12mol/L,溶液中C(OH-)来自于水的电离,水电离出的C(H+)=C(OH-)=10-12mol/L,pH=2的醋酸中水的电离度为α2,α2<α1;
pH=12的氢氧化钠溶液中C(H+)=10-12mol/L,溶液中C(H+)来自于水的电离,水电离出的C(H+)=C(OH-)=10-12mol/L,pH=12的氢氧化钠溶液中水的电离度为α3,α2=α3<α1;
醋酸为弱电解质,pH=2的醋酸和pH=12的氢氧化钠按等体积混合,醋酸过量,所得溶液呈酸性,所以反应后所得溶液中水的电离度为α4<α1,
故选A.
点评 本题主要考查了水的电离平衡的影响因素,注意Kw,温度升高可以促进水电离Kw增大,本题难度不大.

 53随堂测系列答案
53随堂测系列答案| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠和冷水反应 Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O | |
| D. | 少量NaHCO3溶液与Ca(OH)2溶液反应:OH-+HCO3-═CO32-+H2O |
| A. | 反应中B2O3是氧化剂 | B. | 若消耗2.24LNH3理论上可得2.5gBN | ||
| C. | 填料的作用可使反应物充分接触 | D. | 反应时NH3需要用无水CaCl2干燥 |
| A. | C2H4 | B. | C2H6 | C. | C3H6 | D. | C4H8 |
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1min内的平均速率为v(SO3)=0.088/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10molSO3和0.010molO2,到达平衡时,n(SO2)=0.012mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率大于88% |
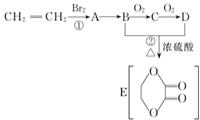 由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)
由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)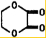 +2H2O.
+2H2O. 向电解质溶液中加入新物质时,其导电性符合如图所示变化趋势的实验操作是②.
向电解质溶液中加入新物质时,其导电性符合如图所示变化趋势的实验操作是②.