题目内容
2. 向电解质溶液中加入新物质时,其导电性符合如图所示变化趋势的实验操作是②.
向电解质溶液中加入新物质时,其导电性符合如图所示变化趋势的实验操作是②.①NaOH溶液中通入Cl2至过量
②硫酸镁溶液中加入Ba(OH)2溶液至过量
③氨水中加入乙酸溶液至过量
④磷酸溶液中滴加NaOH溶液至过量.
分析 电解质溶液导电能力主要取决于自由移动离子浓度的大小,另外电荷数越高,导电能力越强.
①由2NaOH+Cl2═NaCl+NaClO+H2O 和Cl2+H2O=HCl+HClO,分析溶液中离子浓度变化;
②MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓,离子浓度减小,Ba(OH)2溶液过量时,离子浓度开始增大;
③乙酸和一水合氨都是弱电解质,二者反应生成强电解质醋酸铵,增大了溶液中的离子浓度;
④磷酸是弱电解质,磷酸和过量NaOH反应生成强电解质磷酸钠,使溶液中离子浓度增大,导电能力增强.
解答 解:①由2NaOH+Cl2═NaCl+NaClO+H2O 可知,离子浓度基本不变,导电能力基本不变,当氯气过量时,Cl2+H2O=HCl+HClO,溶液中离子浓度增大,导电能力增强,与图象不符;
②由MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓可知,离子浓度减小,导电能力减小,Ba(OH)2溶液过量时,离子浓度开始增大,导电能力增强,与图象相符;
③乙酸和一水合氨都是弱电解质,二者反应生成强电解质醋酸铵,增大了溶液中的离子浓度,导电能力增强,与图象不符;
④磷酸是弱电解质,磷酸和过量NaOH反应生成强电解质磷酸钠,使溶液中离子浓度增大,导电能力增强,与图象不符;
故答案为:②.
点评 本题考查了电解质溶液的导电性,难度中等,掌握影响电解质溶液导电能力的因素是基础,明确选项中发生的化学反应是关键.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
13.25℃时纯水的电离程度为α1,pH=2的醋酸溶液中水的电离程度为α2,pH=12的氢氧化钠溶液中水的电离程度为α3.若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离程度为α4.下列关系式中正确的是( )
| A. | α2=α3<α4<α1 | B. | α3=α2<α1<α4 | C. | α2<α3<α1<α4 | D. | α1<α2<α3<α4 |
14.Na、Mg、Al 三种金属各 2mol 分别跟足量的盐酸反应时,相同条件下放出氢气体积最大的是( )
| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |
7.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4L四氯化碳的分子数约为NA个 | |
| B. | 将含1molFeCl3的饱和溶液制成胶体,最后得到NA个Fe(OH)3胶粒 | |
| C. | 6.5gZn与足量HNO3反应,转移0.2NA个电子 | |
| D. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol•L-1,则Na+个数为2NA |
16.2011年3月11日在日本东太平洋发生里氏9.0级特大地震,福岛一座核电站四个机组发生爆炸,造成具有放射性物质碘-131(原子序数53)等发生泄漏,引发核危机,在我国部分地区还引发抢购碘盐的闹剧.下列有关碘说法正确的是( )
| A. | 131I是一种新发现的元素 | |
| B. | 我们平常食用的加碘盐就是含有碘单质的食盐 | |
| C. | 卤素F、Cl、Br、I中,I的电负性和第一电离能都最小 | |
| D. | 碘单质易升华是由于碘原子半径大,共价键键能小 |
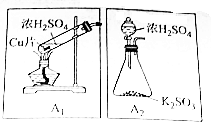 二氧化硫(SO2)是中学化学中常见的气体,在生产生活中用途广泛,某化学课题小组对其进行了实验探究,方案如下:
二氧化硫(SO2)是中学化学中常见的气体,在生产生活中用途广泛,某化学课题小组对其进行了实验探究,方案如下: 汽化 ②将胆矾加热变为白色粉末
汽化 ②将胆矾加热变为白色粉末 2CO
2CO 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.