题目内容
1.反应4NH3(g)+502(g)?4N0(g)+6H20(g)在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则NH3平均每秒钟浓度变化正确的是( )| A. | 0.001 mol•L-1 | B. | O.002 mol•L-1 | C. | 0.003 mol•L-1 | D. | O.00125 mol•L-1 |
分析 根据公式△c=$\frac{△n}{V}$计算每分钟内的变化,然后依据分钟与秒的关系换算后,选择答案即可.
解答 解:由1分钟后,NH3减少了0.12摩尔,则每秒钟内△c(NH3)=$\frac{0.12mol}{2L}$=0.06mol/L,1min=60s,故每秒的变化为0.06÷60=0.001mol/L,故选A.
点评 本题考查化学反应速率的有关计算,注意根据速率定义式理解速率规律,有利于基础知识的巩固.

练习册系列答案
相关题目
11.下列有关电解质溶液的说法正确的是( )
| A. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-)>c(H+) | |
| C. | pH相同的 ①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$增大 |
12.下列物质的沸点最高的是( )
| A. | 氯乙烷 | B. | 乙醇 | C. | 甲醛 | D. | 丁烷 |
9.欲除去甲烷气体中混有的乙烯得到纯净的甲烷,最好依次通过盛有( )试剂的装置.
| A. | 澄清石灰水、浓H2SO4 | B. | 酸性KMnO4溶液、浓H2SO4 | ||
| C. | 溴水、浓H2SO4 | D. | CCl4、碱石灰 |
16.下列实验现象正确的是( )
| A. | 将SO2气体通入Ba(NO3)2溶液中有白色沉淀生成 | |
| B. | 将足量的SO2气体通入Ba(OH)2溶液中有白色沉淀生成 | |
| C. | 将SO2气体通入BaCl2溶液中有白色沉淀生成 | |
| D. | 将Na2SO3与BaCl2溶液混合后生成白色沉淀,加稀硝酸沉淀全部溶解 |
6.下列有关“化学与生活”的叙述不正确的是( )
| A. | 点燃爆竹后,硫燃烧生成SO3 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 硅胶可用作食品干燥剂 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
13.卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁.

查阅资料得下表相关数据:
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽.
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的acd(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)步骤③控制pH=9.8的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、坩埚和泥三角.
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3•H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动.

查阅资料得下表相关数据:
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的acd(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)步骤③控制pH=9.8的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、坩埚和泥三角.
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3•H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
11.某同学用5%的H2O2溶液做了一个探究实验,实验步骤如下:
步骤1:分别在2支大小相同的试管1和试管2中装入3.0mL5%的H2O2溶液.
步骤2:再分别往两支试管中滴入1~2滴1mol/L FeCl3溶液,
待试管中均有适量气泡出现时,将试管1放入盛有温度恒定为5℃冷水的烧杯中,试管2放入盛有温度恒定为40℃热水的烧杯中,同时用排水法收集产生的气体,并记录不同时刻(min)气体的总体积(mL),数据如下:
(1)向试管中加入的FeCl3溶液的作用起催化作用,写出加入FeCl3溶液后发生的化学反应方程式:2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑;
(2)相同时刻试管2中收集到的气体体积比试管1中多的原因是:2中温度高,由此该同学可以得出的实验结论是:温度越高反应速率越快;
(3)对比每分钟内收集到的气体体积变化,前5分钟内每分钟收集到的气体体积逐渐减小的原因是:H2O2的浓度随着反应的进行逐渐减小;
(4)若用单位时间内收集到的气体体积表示反应的快慢,则2min到5min试管2中生成气体的速率为:$\frac{81.3mL-41.2mL}{5min-2min}$=13.4mL/min.(请列出计算式并将计算结果保留3位有效数字)
步骤1:分别在2支大小相同的试管1和试管2中装入3.0mL5%的H2O2溶液.
步骤2:再分别往两支试管中滴入1~2滴1mol/L FeCl3溶液,
待试管中均有适量气泡出现时,将试管1放入盛有温度恒定为5℃冷水的烧杯中,试管2放入盛有温度恒定为40℃热水的烧杯中,同时用排水法收集产生的气体,并记录不同时刻(min)气体的总体积(mL),数据如下:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 试管1 | 17.5 | 34.9 | 50.1 | 60.3 | 70.4 | 80.2 | 84.9 | 85.2 | 85.4 |
| 试管2 | 21.7 | 41.2 | 57.5 | 70.8 | 81.3 | 84.9 | 85.3 | 85.4 | 85.4 |
(2)相同时刻试管2中收集到的气体体积比试管1中多的原因是:2中温度高,由此该同学可以得出的实验结论是:温度越高反应速率越快;
(3)对比每分钟内收集到的气体体积变化,前5分钟内每分钟收集到的气体体积逐渐减小的原因是:H2O2的浓度随着反应的进行逐渐减小;
(4)若用单位时间内收集到的气体体积表示反应的快慢,则2min到5min试管2中生成气体的速率为:$\frac{81.3mL-41.2mL}{5min-2min}$=13.4mL/min.(请列出计算式并将计算结果保留3位有效数字)
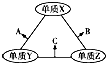 (Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题:
(Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题: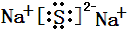 .(用元素符号表示)
.(用元素符号表示)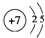 .
.