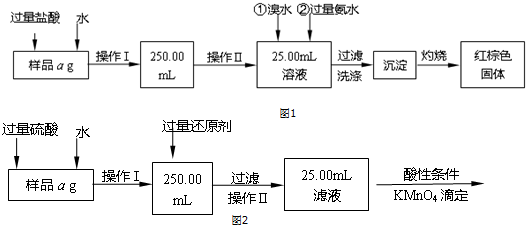
题目内容
10.A、B、C、D、E、F均为短周期元素,其原子序数依次增大.已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F同主族;E是所有短周期主族元素中原子半径最大的元素.根据以上信息回答下列问题:(1)B与D形成化合物BD2的结构式为O=C=O,B元素形成的同素异形体的晶体类型可能是原子晶体、分子晶体.
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O. FD2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+.
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为H++HSO3-═SO2↑+H2O;;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-.
分析 A、B、C、D、E、F均为短周期元素,其原子序数依次增大.B的最外层电子数是次外层电子数的两倍,则B有2个电子层,最外层有4个电子,则B为碳元素;D是地壳中含量最高的元素,则D为氧元素;D和F同主族,则F为硫元素;C元素介于氧元素与碳元素之间,则C为氮元素;E是所有短周期主族元素中原子半径最大的元素,则E为钠元素;A和E同主族,A的最外层电子数等于其电子层数,则A为氢元素,据此解答.
解答 解:A、B、C、D、E、F均为短周期元素,其原子序数依次增大.B的最外层电子数是次外层电子数的两倍,则B有2个电子层,最外层有4个电子,则B为碳元素;D是地壳中含量最高的元素,则D为氧元素;D和F同主族,则F为硫元素;C元素介于氧元素与碳元素之间,则C为氮元素;E是所有短周期主族元素中原子半径最大的元素,则E为钠元素;A和E同主族,A的最外层电子数等于其电子层数,则A为氢元素,
(1)B与D形成化合物BD2为CO2,结构式为O=C=O,碳元素形成的同素异形体的晶体类型可能是原子晶体、分子晶体,故答案为:O=C=O;原子晶体、分子晶体;
(2)H、N、O三元素能形成一种强酸甲为HNO3,单质碳与浓硝酸反应的化学反应方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
SC2气体通入BaCl2和硝酸的混合溶液,生成白色沉淀和无色气体NO,该白色沉淀为硫酸钡,反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+;
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,则该两种盐为NaHSO4、NaHSO3,二者反应的离子方程式为H++HSO3-═SO2↑+H2O,由B、D、E组成的盐为 Na2CO3,碳酸钠是强碱弱酸盐,碳酸根水解 CO32-+H2O?HCO3-+OH-,使溶液呈碱性,
故答案为:H++HSO3-═SO2↑+H2O; CO32-+H2O?HCO3-+OH-.
点评 本题考查结构与位置关系、原电池、元素化合物性质等,难度中等,推断元素是关键,是对所学知识的综合运用与学生能力考查,注意基础知识的掌握.

 考前必练系列答案
考前必练系列答案根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程:
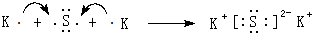 .
.(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
| A. | 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2 | |
| B. | 等质量的O2与O3中,氧原子的个数比为3:2 | |
| C. | CaCl2及CaO2固体中阴、阳离子数之比均为2:1 | |
| D. | 10mL 0.3mol/LNaCl与30mL0.1mol/LAlCl3溶液中Cl-物质的量浓度比为1:3 |
| A. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 | |
| B. | 光导纤维应避免在强碱性环境中使用 | |
| C. | 硅胶多孔、吸水能力强,常用作袋装食品的干燥 | |
| D. | 陶瓷、水泥、玻璃、大理石属于硅酸盐产品 |
| A. | ${\;}_{8}^{18}$O,${\;}_{8}^{17}$O | B. | O2,O3 | C. | Fe3+,Fe2+ | D. | ${\;}_{6}^{12}$C,${\;}_{6}^{13}$C |


 ,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种.
,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种. .
.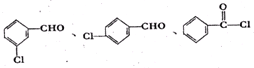 (不考虑立体异构).
(不考虑立体异构).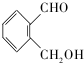 为有机原料制备化合物
为有机原料制备化合物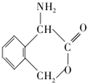 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).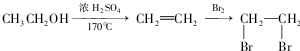 )
)
 A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知: